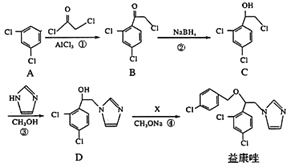
题目内容
【题目】如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯缓慢加热
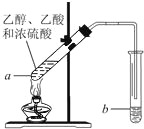
(1)写出左试管中主要反应的方程式________________;
(2)饱和Na2CO3的作用:___________;_______________________;_________;
(3)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作所需主要仪器是____________.
(4)实验生成的乙酸乙酯,其密度比水________.
【答案】 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O; 除去乙酸 吸收乙醇 降低乙酸乙酯的溶解度,便于分层 分液漏斗 小
CH3COOCH2CH3+H2O; 除去乙酸 吸收乙醇 降低乙酸乙酯的溶解度,便于分层 分液漏斗 小
【解析】(1)左试管中主要反应是乙酸与乙醇的酯化反应,方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;(2)生成的乙酸乙酯中含有乙醇与乙酸,因此饱和Na2CO3的作用是除去乙酸、吸收乙醇、降低乙酸乙酯的溶解度,便于分层;(3)乙酸乙酯不溶于水,所以分离右试管中所得乙酸乙酯和Na2CO3溶液的操作是分液,所需主要仪器是分液漏斗;(4)实验生成的乙酸乙酯,其密度比水小。
CH3COOCH2CH3+H2O;(2)生成的乙酸乙酯中含有乙醇与乙酸,因此饱和Na2CO3的作用是除去乙酸、吸收乙醇、降低乙酸乙酯的溶解度,便于分层;(3)乙酸乙酯不溶于水,所以分离右试管中所得乙酸乙酯和Na2CO3溶液的操作是分液,所需主要仪器是分液漏斗;(4)实验生成的乙酸乙酯,其密度比水小。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目