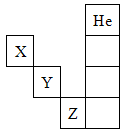题目内容
3月11日日本发生9级地震导至福岛核电站发生爆炸,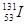 、
、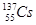 、
、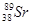 、
、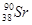 等放射性元素或物质发生泄露。下列说法错误的是
等放射性元素或物质发生泄露。下列说法错误的是
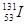 、
、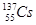 、
、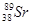 、
、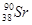 等放射性元素或物质发生泄露。下列说法错误的是
等放射性元素或物质发生泄露。下列说法错误的是A.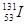 原子核内有78个中子 原子核内有78个中子 | B.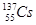 的质量数为137 的质量数为137 |
C.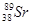 核外电子数为51 核外电子数为51 | D.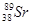 、 、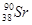 互为同位素 互为同位素 |
C
答案:C
C不正确,核外电子数=质子数=38

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 ,熔成小球,做不定向运动,随之消失,溶液变成红色。
,熔成小球,做不定向运动,随之消失,溶液变成红色。 2
2

 ____ ;
____ ;