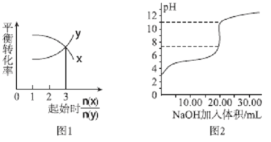
��Ŀ����
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ����ڱ���ǰ������Ԫ��R��W��X��Y��Z��ԭ���������ε�����R��̬ԭ���У�����ռ�ݵ�����ܲ����ΪL������ܼ���ֻ����������������ͬ�ĵ��ӡ���ҵ��ͨ������Һ̬�������X���ʡ�Yԭ�ӵ���������������Ӳ���֮������R��W��X����Ԫ�ص�ԭ������֮�͡�Z��̬ԭ�ӵ������ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӡ���ش��������⣺
��1��Z2+��̬��������Ų�ʽΪ��_______________________��
��2��YX4-�Ŀռ乹���ǣ�_________��HYX4���Ա�HYX2ǿ����ԭ���ǣ�_______________��
��3���ṹ��ʽΪRX(WH2)2�Ļ�������Rԭ�ӵ��ӻ��������Ϊ��________________ (HΪ��Ԫ�أ���ͬ��
��4����Z����������Һ��ͨ�������WH3��������[Z(WH3)4]SO4������˵����ȷ���ǣ�____________��A��[Z(WH3)4]SO4�������Ļ�ѧ�������Ӽ������Լ�����λ��
B����[Z(WH3)4]2+��Z2+�����¶Ե��ӣ�WH3�ṩ�չ����
C��[Z(WH3)4]SO4���Ԫ���е�һ��������������Ԫ��
��5��ijY��Z�γɵĻ�����ľ�������ͼ��ʾ (�ڵ����Zԭ��)��
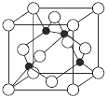
���þ���Ļ�ѧʽΪ____________��
����֪�þ�����ܶ�Ϊ��g��cm-3�������ӏ�����ΪNA����þ�����Zԭ�Ӻ�Yԭ��֮�����̾���Ϊ___________�M(ֻд����ʽ)(Zԭ��λ����Խ����ϣ���
���𰸡�(l)[Ar]3d9��ls22s22p63s23p63d9(2��)
��2����������(2�֣�HClO4��3�����ǻ�������HClO2��1�����ǻ���(2��)
��3��sp2(2��)��4��A(2��)��5����CuCl(2��)�� (3��)
(3��)
��������������������ڱ���ǰ������Ԫ��R��W��X��Y��Z��ԭ���������ε�����R��̬ԭ���У�����ռ�ݵ�����ܲ����ΪL������ܼ���ֻ����������������ͬ�ĵ��ӣ���������Ų�ʽΪ1s22s22p2����RΪCԪ�أ���ҵ��ͨ������Һ̬�������X���ʣ����ԭ��������֪XΪOԪ�ء�WΪNԪ�أ�Yԭ�ӵ���������������Ӳ���֮������R��W��X����Ԫ�ص�ԭ������֮�ͣ���Ԫ��ԭ������֮��Ϊ6+7+8��21����YΪClԪ�أ�Z��̬ԭ�ӵ������ܲ�ֻ��һ�����ӣ������ܲ���ѳ������ӣ�ԭ�����������ȣ����ڵ������ڣ����������Ϊ2+8+18+1=29����ZΪCu����
��1��Cu2+��̬��������Ų�ʽΪ[Ar]3d9�� ls22s22p63s23p63d9��
��2��ClO4-��Clԭ�ӹµ��Ӷ���=��7+12��4����2=0���۲���Ӷ���=4+0=4������ռ乹�����������壻HClO4�� 3 �����ǻ������� HClO2�� 1 �����ǻ�����HClO4���Ա�HClO2ǿ��
��3���ṹ��ʽΪCO��N2H3��2�Ļ�������̼ԭ���γ�3��������û�й¶Ե��ӣ��ӻ������ĿΪ3��̼ԭ�ӵ��ӻ��������Ϊsp2��
��4����CuSO4��Һ��ͨ�������NH3��������[Cu��NH3��4]SO4��A��[Cu��NH3��4]SO4������������������֮���γ����Ӽ���ͭ�����백������֮���γ���λ��������������������к��м��Լ���A��ȷ��B����[Cu��NH3��4]2+��Cu2+�ṩ�չ����NH3�����¶Ե��ӣ�B����C���ǽ�����Խǿ����һ������Խ��Ԫ��2p���Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ�����Ԫ�صģ�[Cu��NH3��4]SO4���Ԫ���е�һ������������NԪ�أ�C����ѡA��
��5���������к�ɫ����ĿΪ4����ɫ����ĿΪ8��1/8+6��1/2=4���þ���Ļ�ѧʽΪCuCl��
����ɫ������Χ��4����ɫ�����ڣ��γ���������ṹ����ɫ���뾧�������ɫ�����ߴ��ھ�������Խ����ϣ�Ϊ���߾���Ϊ��Խ��߳��ȵ�1/4������Խ��߳���Ϊ�����ⳤ��![]() ������������Ϊ
������������Ϊ![]() g���þ�����ܶ�Ϊ��g/cm-3�����ⳤΪ
g���þ�����ܶ�Ϊ��g/cm-3�����ⳤΪ ���ʸþ�����Zԭ�Ӻ�Yԭ��֮�����̾���Ϊ
���ʸþ�����Zԭ�Ӻ�Yԭ��֮�����̾���Ϊ![]() ��
��