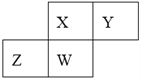
��Ŀ����
����Ŀ��һ���¶��£���ij�ܱ������г���1.6 molH2��1.0molCO���������¿��淴Ӧ���ﵽƽ�⣺H2��g��+CO��g��C��s��+H2O��g��+Q kJ��Q>0��.��ѹ�����������ͬʱ�����¶ȣ��ﵽ��ƽ����������������ı仯�������������ǣ� ��
A.��Ӧ����һ������
B.ƽ�ⳣ��һ����С
C.��������ƽ��Ħ���������ܼ�С
D.H2O��g�������������������
���𰸡�C
��������
���ڷ�ӦH2(g)��CO(g)C(s)��H2O(g)+QkJ(Q>0)������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����С�������������ѹǿ��ƽ�������ƶ���ƽ��������ô�ƶ�����Ա����º�ѹǿ�ĸ�Ӱ��̶ȴݴ˷������
A�������¶ȡ�����ѹǿ����ʹ��Ӧ�������ʷ�Ӧ����һ������A��ȷ��
B��ƽ�ⳣ��ֻ���¶��йأ������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С��B��ȷ��
C��һ���¶��£���ij�ܱ������г���1.6molH2��1.0molCO��ƽ��Ħ������Ϊ![]() =12g/mol������H2(g)��CO(g)C(s)��H2O(g)��������ȫ��Ӧ����CO��Ӧ��ȫ��ʣ��0.6molH2������1molH2O(g)����ʱ����ƽ��Ħ������Ϊ
=12g/mol������H2(g)��CO(g)C(s)��H2O(g)��������ȫ��Ӧ����CO��Ӧ��ȫ��ʣ��0.6molH2������1molH2O(g)����ʱ����ƽ��Ħ������Ϊ![]() =12g/mol��˵����Ӧǰ���������ƽ��Ħ���������䣬������������ƽ�����ĸ������ƶ�����������ƽ��Ħ�����������䣬C����
=12g/mol��˵����Ӧǰ���������ƽ��Ħ���������䣬������������ƽ�����ĸ������ƶ�����������ƽ��Ħ�����������䣬C����
D����ѹǿӰ��ϴ�ƽ�������ƶ��������ܷ��������٣�����H2O���������࣬��H2O(g)�������������D��ȷ��
�ʴ�ѡC��

 �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�����Ŀ����20 mL 0.40 mol/L H2O2��Һ�м�������KI��Һ������H2O2+I-=H2O+IO��������H2O2+IO��= H2O+O2��+ I����H2O2�ֽⷴӦ�����������仯�Ͳ�ͬʱ�̲������O2�����(�������״��)���¡�

t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
�����ж�����ȷ����
A. ��ͼ�п��Կ�����KI������H2O2�ķֽ�����
B. ��Ӧ���Ƿ��ȷ�Ӧ����Ӧ�������ȷ�Ӧ
C. 0~10 min��ƽ����Ӧ���ʣ�v(H2O2)��9.0��10-3 mol/(L��min)
D. H2O2�ڷ�Ӧ�����м������������ԣ��������˻�ԭ��