题目内容
环保部门测定某气体样品中一氧化碳的含量,其方法和实验步骤如下:
(1)将2.000 L的气体样品通过盛有I2O5固体的加热管,发生的反应为:5CO+I2O5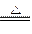 5CO2+I2。
5CO2+I2。
(2)将所产生的碘升华,并加入30.00 mL 0.005 0 mol·L-1的硫代硫酸钠溶液,发生的反应为:I2+2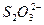 ====2I-+
====2I-+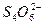 。
。
(3)将(2)中溶液取出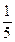 ,加入1.00 mL 0.010 0 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
,加入1.00 mL 0.010 0 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
试计算1 L该气体样品中有多少毫克(mg)的CO。
(1)将2.000 L的气体样品通过盛有I2O5固体的加热管,发生的反应为:5CO+I2O5
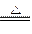 5CO2+I2。
5CO2+I2。(2)将所产生的碘升华,并加入30.00 mL 0.005 0 mol·L-1的硫代硫酸钠溶液,发生的反应为:I2+2
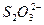 ====2I-+
====2I-+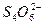 。
。(3)将(2)中溶液取出
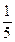 ,加入1.00 mL 0.010 0 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。
,加入1.00 mL 0.010 0 mol·L-1的碘水,正好将所取溶液中过量的Na2S2O3全部氧化。试计算1 L该气体样品中有多少毫克(mg)的CO。
1.75 mg
根据题意,反应中各物质间的关系为:5CO—I2—2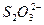
得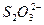 与CO和I2O5反应生成的I2的物质的量为:
与CO和I2O5反应生成的I2的物质的量为:
n(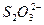 )="0.005" 0 mol·L-1×30.00 mL×10-3L·mL-1-5×0.010 0 mol·L-1×1.00 mL×10-3 L·mL-1×2=5.00×10-5 mol
)="0.005" 0 mol·L-1×30.00 mL×10-3L·mL-1-5×0.010 0 mol·L-1×1.00 mL×10-3 L·mL-1×2=5.00×10-5 mol
n(CO)=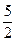 n(
n(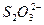 )=
)=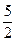 ×5.00×10-5 mol=1.25×10-4 mol
×5.00×10-5 mol=1.25×10-4 mol
m (CO)=1.25×10-4 mol×28 g·mol-1=3.50×10-3 g
c (CO)= =1.75×10-3 g·L-1="1.75" mg·L-1。
=1.75×10-3 g·L-1="1.75" mg·L-1。
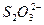
得
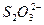 与CO和I2O5反应生成的I2的物质的量为:
与CO和I2O5反应生成的I2的物质的量为:n(
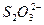 )="0.005" 0 mol·L-1×30.00 mL×10-3L·mL-1-5×0.010 0 mol·L-1×1.00 mL×10-3 L·mL-1×2=5.00×10-5 mol
)="0.005" 0 mol·L-1×30.00 mL×10-3L·mL-1-5×0.010 0 mol·L-1×1.00 mL×10-3 L·mL-1×2=5.00×10-5 moln(CO)=
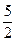 n(
n(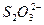 )=
)=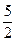 ×5.00×10-5 mol=1.25×10-4 mol
×5.00×10-5 mol=1.25×10-4 molm (CO)=1.25×10-4 mol×28 g·mol-1=3.50×10-3 g
c (CO)=
 =1.75×10-3 g·L-1="1.75" mg·L-1。
=1.75×10-3 g·L-1="1.75" mg·L-1。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目