题目内容
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验,请回答下列问题:
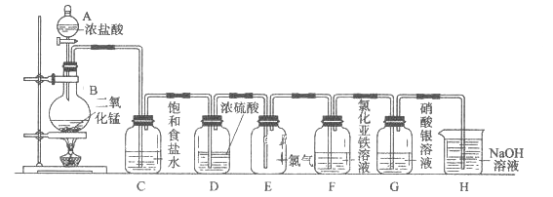
(1)A中盛有浓盐酸,B中盛有MnO![]() ,则烧瓶中发生反应的化学方程式为:______。
,则烧瓶中发生反应的化学方程式为:______。
(2)C中盛有饱和食盐水,其作用是_________,装置D的作用_________。
(3)装置E中气体的颜色为_______,E中Cl![]() 能使湿润的红色布条褪色的原因是________。
能使湿润的红色布条褪色的原因是________。
(4)F中是FeCl![]() 溶液,现象是________,发生反应的离子方程式为__________。
溶液,现象是________,发生反应的离子方程式为__________。
(5)G中是AgNO![]() 溶液,现象是___________,有关化学反应的离子方程式为_________。
溶液,现象是___________,有关化学反应的离子方程式为_________。
(6)H中盛有NaOH溶液,其作用是_______,发生反应的化学方程式为_________。
【答案】MnO2+4HCl(浓)![]() MnCl2 +Cl2↑+2H2O 除去HCl气体杂质 干燥氯气 黄绿色 Cl2与H2O反应生成HClO,HClO具有漂白性使红色布条退色 浅绿色溶液变黄色 2Fe2++Cl2=2Fe3++2Cl- 有白色沉淀生成 Ag++Cl-=AgCl↓ 吸收多余的氯气,防止污染环境 Cl2+2NaOH=NaCl+NaClO+H2O
MnCl2 +Cl2↑+2H2O 除去HCl气体杂质 干燥氯气 黄绿色 Cl2与H2O反应生成HClO,HClO具有漂白性使红色布条退色 浅绿色溶液变黄色 2Fe2++Cl2=2Fe3++2Cl- 有白色沉淀生成 Ag++Cl-=AgCl↓ 吸收多余的氯气,防止污染环境 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
由图可知,分液漏斗A中浓盐酸与烧瓶中二氧化锰混合,共热反应生成氯气,C中盛有饱和食盐水的作用是除去氯气中混有的挥发出的HCl气体,装置D中盛有的浓硫酸用于干燥氯气,装置E用于收集干燥的氯气,装置F中氯化亚铁溶液被氯气氧化生成氯化铁溶液,溶液颜色发生变化,装置G中硝酸银溶液与氯气反应生成氯化银白色沉淀,装置H中氢氧化钠溶液吸收多余的氯气,防止污染环境。
(1)浓盐酸具有还原性,二氧化锰具有氧化性,浓盐酸和二氧化锰共热发生氧化还原反应生成氯化锰、氯气和水,反应化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)制得的氯气中混有的挥发出的HCl气体和水蒸气,因氯气溶于水,氯化氢极易溶于水,装置C中盛有饱和食盐水降低氯气的溶解度,除去HCl气体杂质;浓硫酸有吸水性,装置D中浓硫酸可以干燥氯气,制得纯净的氯气,故答案为:除去HCl气体杂质;干燥氯气;
(3)Cl2为有刺激性气味的黄绿色气体;干燥的氯气没有漂白性,不能使干燥的有色布条褪色,氯气和水反应生成的次氯酸具有强氧化性,次氯酸能使湿润的有色布条漂白褪色,故答案为:黄绿色;Cl2与H2O反应生成HClO,HClO具有漂白性使红色布条退色;
(4)Cl2具有强氧化性,能将浅绿色的氯化亚铁溶液被氯气氧化生成棕黄色的氯化铁溶液,反应的化学方程式为2FeCl2+Cl2=2FeCl3,故答案为:溶液从浅绿色变为棕黄色;2FeCl2+Cl2
=2FeCl3;
(5)装置G中盛有的是AgNO3溶液,氯气和水反应生成盐酸和次氯酸,氯离子和银离子反应生成白色难溶于水的氯化银,故答案为:有白色沉淀生成;Cl-+Ag+=AgCl↓;
(6)氯气有毒,直接排空会污染环境,氯气能和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以可用氢氧化钠溶液吸收多余的氯气,防止污染环境,反应化学方程式为Cl2+2NaOH=
NaCl+NaClO+H2O,故答案为:吸收多余的氯气;2NaOH+Cl2=NaCl+NaClO+H2O。