题目内容
13.假定元素周期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说.
(1)已知元素周期表中的各周期可排元素种类如下:
| 周期 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
A.18 B.32 C.50 D.无法判断
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看做非金属元素),预测周期表中应该有23种非金属元素,还有1种未发现.未发现的非金属元素处于七周期0族.
(3)小明同学所在的化学探究小组,在查阅相关资料后归纳出元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.
回答下列问题:
①请在图中将过渡元素所在的位置涂黑.
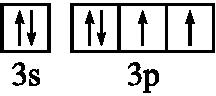
②画出B元素价电子排布图
 .
.
分析 (1)由已知可归纳出周期为一、二、三、四、五、六、七元素种数:2×12(第一)、2×22(第二、三)、2×32(第四、五)、2×42(第六、七),据此预测第八周期元素种数;
(2)由周期表可知非金属元素的种类:第一、二、三、四、五、六周期非金属元素种数分别为:2、6、5、4、3、2,除第一周期外,各周期非金属元素种数=8-周期数;
(3)①通过观察三角形元素周期表发现,每一横行代表一周期,每一纵行代表一族.过渡元素是指元素周期表中副族元素和第Ⅷ族元素,即最下面两行中的第3~12列.
②B元素为硫元素,价电子排布式为2s23p4,结合泡利原理、洪特规则画出价电子排布图.
解答 解:(1)由已知可归纳出周期为一、二、三、四、五、六、七元素种数:2×12(第一)、2×22(第二、三)、2×32(第四、五)、2×42(第六、七),据此预测第八周期元素种数为2×52=50(种),
故答案为:50;
(2)由周期表可知非金属元素的种类:第一、二、三、四、五、六周期非金属元素种数分别为:2、6、5、4、3、2,除第一周期外,各周期非金属元素种数=8-周期数,则可类推第七、八周期非金属元素种数分别为:1、0,共计23种,第七周期未填满,有一种非金属元素未发现,将处在第0族,
故答案为:23;1;七、0;
(3)①通过观察三角形元素周期表发现,每一横行代表一周期,每一纵行代表一族.过渡元素是指元素周期表中副族元素和第Ⅷ族元素,即最下面两行中的第3~12列,如图所示: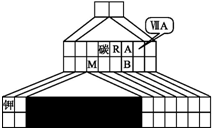 ,故答案为:
,故答案为: ;
;
②B元素为硫元素,价电子排布式为2s23p4,结合泡利原理、洪特规则,可知价电子排布图为 ,
,
故答案为: .
.
点评 本题考查元素周期表、核外电子排布,元素周期表的终点在哪里,元素周期表排满时到底能排多少种元素,这些都是还没有定论的问题,本题在假定元素周期表有限的基础上,要求预测终点元素的位置和没有被发现的非金属元素,对元素周期表的结构和元素的排布规律进行了深入的考查,难度中等.

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | c | d | f | ||||
| 3 | a | b | e |
| A. | e的氢化物比d的氢化物稳定 | |
| B. | a~f六种元素中,相互之间最易形成离子键的是a和f | |
| C. | a~f六种元素中,原子半径最大的是e | |
| D. | 由a、d两种元素形成的离子化合物中,不可能含有共价键 |
[X]$\stackrel{M}{→}$[Y]$\stackrel{M}{→}$[Z]
| 选项 | X | Y | Z | M |
| A | Fe | FeCl2 | FeCl3 | Cl2 |
| B | Mg | C | CO | CO2 |
| C | NaOH | Na2CO3 | NaHCO3 | CO2 |
| D | NH3 | NO | NO | O 2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 单晶硅 | B. | 普通玻璃 | C. | 二氧化硅 | D. | 聚氯乙烯纤维 |
| A. | 0.3mol | B. | 0.3NA mol | C. | 0.9NA mol | D. | 0.9 mol |
| A. | 加压 | B. | 增加C的浓度 | C. | 增加B的浓度 | D. | 加热 |
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 乙醇 |
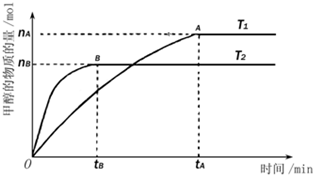 甲醇是一种新型的能源.
甲醇是一种新型的能源.