题目内容
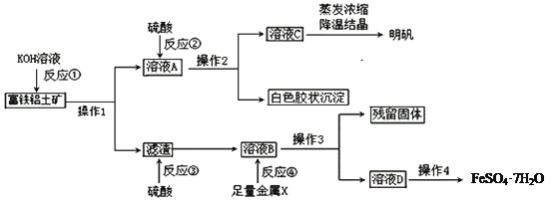
【题目】已知某可逆反应mA(g)+nB(g) ![]() pC(g) △H 在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示.下列判断正确的是
pC(g) △H 在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示.下列判断正确的是
A. m+n>P, △H>0 B. m+n<P, △H>0
C. m+n<P, △H<0 D. m+n>P, △H<0
【答案】B
【解析】
根据“先拐先平,数值大”原则,采取定一议二得到温度和压强的大小关系,根据图示,结合压强和B的含量的关系判断方程式前后的系数和大小关系,根据温度和B的含量的关系,确定化学反应的吸放热情况。
定压强相同,比较温度不同时,即比较曲线T1、P2与曲线T2、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的温度高,所以T1 >T2,由图知温度越高,B的含量越低,所以平衡向正反应进行,升高温度,平衡向吸热方向移动,故正反应为吸热反应,即△H>0;
定温度相同,比较压强不同时,即比较曲线T1、P1与曲线T1、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的压强高,所以P1 <P2,由图知压强越大,B的含量越高,所以平衡向逆反应进行,增大压强,平衡向体积减小的方向移动,所以m+n<P;
根据以上分析得出:T1 >T2,,△H>0,P1 <P2,m+n<P,
所以B选项是正确的。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目