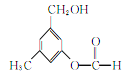
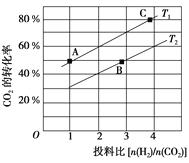
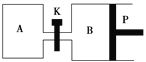
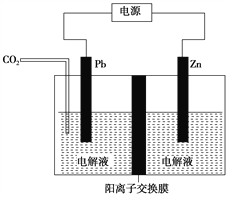
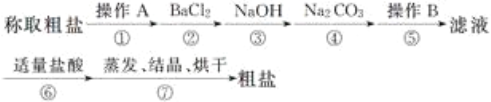
题目内容
【题目】根据反应 8NH3 + 3Cl2 = N2 + 6NH4Cl,回答下列问题:
①用双线桥法标出该反应中电子转移的方向和数目:_____.
②该反应中_____元素被还原,_____元素被氧化.
③氧化剂和还原剂的物质的量之比为_____.
④在该反应中,若有 3mol 电子发生转移,在标准状况下,可生成N2的体积为_____L.
【答案】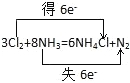 Cl N 3:2 11.2
Cl N 3:2 11.2
【解析】
该反应中N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,所以NH3是还原剂、Cl2是氧化剂,再结合氮气和还原剂之间的关系式计算生成氮气的体积。
①用双线桥标出电子转移的方向和数目可为  ,
,
因此,本题正确答案是: ;
;
②该反应中N元素化合价由-3价变为0价,被氧化,Cl元素化合价由0价变为-1价,被还原,
因此,本题正确答案是:Cl;N;
③由方程式可以知道,当有8mol氨气参加反应,有2mol被氧化,同时有3mol氯气参加反应,氧化剂和还原剂的物质的量之比为3:2,
因此,本题正确答案是:3:2;
④N元素化合价由-3价升高0价,在当反应过程中有3mol电子转移时,有0.5mol氮气生成,标准状况下的体积为0.5mol![]() 22.4L/mol=11.2L,
22.4L/mol=11.2L,
因此,本题正确答案是:11.2。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目