题目内容
19.请按要求填空:⑴ 下列实验操作或对实验事实的叙述正确的是______________(填序号)
① 用稀HNO3清洗做过银镜反应实验的试管;
② 配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③ 用碱式滴定管量取20.00mL 0.1000mol/L 的KMnO4溶液;
④ 用托盘天平称取10.50g干燥的NaCl固体;
⑤ 不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥ 用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦ 向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧ 配制Al2(SO4)3溶液时,加入少量的稀硫酸。
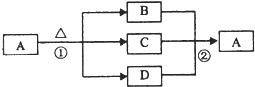
⑵ 为了确定乙醇分子的结构简式是CH3—O—CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目。试回答下列问题:

① 指出实验装置中的错误_________________________。
② 若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得的氢气体积将__________(填“偏大”、“偏小”或“不变”)。
③ 请指出能使该实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)____________________。
答案:
⑴ ①②⑤⑧
⑵ ①广口瓶中进气导管不应插入水中,排水导管应插到广口瓶底部
②偏大
③检查实验装置的气密性;加入稍过量的金属钠;从漏斗中缓慢滴加无水乙醇。
解析:本题综合考查有关实验的安全性操作。仪器的精度及误差分析等内容。(1)KMnO4具有强氧化性,可氧化橡胶管,故不能用碱式滴定管量取KMnO4溶液;托盘天平的最小分度值为0.1 g,不能称量准确至0.01 g的样品;瓷坩埚成份中含有SiO2可与Na2CO3等碱性物质在高温下反应;由胶体的制备原理可知,应向沸水中加入FeCl3饱和溶液制备胶体,而向碱液中加入FeCl3时只会生成Fe(OH)3沉淀,本题答案应为①②⑤⑧;(2)要通过测量排出水的体积确定产生H2的体积,广口瓶中的进气导管不能伸入到液面以下,而排出水导管应伸入到广口瓶底部。由于等质量的水和乙醇,水的物质的量大于乙醇,与金属钠作用时,产生H2的物质的量增大,故用含水乙醇代替无水乙醇时,所得H2体积偏大。要使该实验安全顺利进行,首先要保证该装置不能漏气,为使排出水的体积等于产生氢气的体积,则乙醇的加入速度不能太快,为确保定量乙醇完全反应,金属钠应稍过量。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案