题目内容
【题目】水煤气不仅是一种重要的燃料,也是合成氨的重要原料气.
(1)已知CO和H2燃烧均为放热反应.
①上图能正确表示反应中能量变化的是(选填“图A”或“图B”);
②水煤气燃料电池中,通CO、H2的极为电池的极(选填“正”或“负”).
(2)水煤气变换后反应为:CO(g)+H2O(g)CO2(g)+H2(g)△H<0(放出热量)①下列措施能提高反应速率的有;(填序号)
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
②反应产生的H2可用于工业合成氨气.已知拆开1mol H﹣H键、1molN≡N键分别需要吸收的能量为436kJ、946kJ,形成1molN﹣H键会放出能量391kJ,则在反应N2+3H2═2NH3中,每生成2molNH3填“吸收”或“放出”)热量kJ.当在相同的条件下向容器中充入1molN2和3molH2时,它们反应对应的热量(填“大于”、“等于”或“小于”)你所计算出的值.
【答案】
(1)图A;负
(2)abc;放出;92;小于
【解析】解:(1)①因为放热反应即反应物总能量大于生成物总能量,所以图象A正确,所以答案是:图A;②燃料电池中燃料在负极失电子发生氧化反应,)“直接水煤气燃料电池”中,通CO、H2的极为电池的负极,所以答案是:负;(2)①CO(g)+H2O(g)CO2(g)+H2(g)△H<0,反应是气体体积不变的放热反应,a.升高温度平衡逆向进行,反应速率增大,故a正确; b.加入催化剂能增大反应速率,故b正确; c.增大压强,反应速率增大,故正确; d.降低浓度,反应速率减小,故d错误;所以答案是:abc;②拆1molH﹣H键、1molN≡N、1molN﹣H键分别需要吸收的能量为436kJ、946kJ、391kJ,在反应N2+3H22NH3中,断裂3mol H﹣H键,1molN≡N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3 , 共形成6molN﹣H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ﹣2254kJ=92kJ,当在相同的条件下向容器中充入1molN2和3molH2时,反应物不能完全反应,所以它们反应对应的热量会小于92kJ,所以答案是:放出; 92;小于.
【考点精析】本题主要考查了吸热反应和放热反应和反应热和焓变的相关知识点,需要掌握化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应;在化学反应中放出或吸收的热量,通常叫反应热才能正确解答此题.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过下述流程回收Na2Cr2O7等物质. 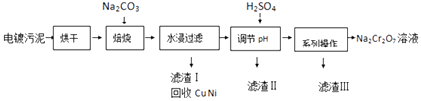
已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
20℃ | 60℃ | 100℃ | |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
(1)焙烧过程中生成Na2CrO4的化学方程式为;水浸后溶液中除Na2CrO4还存在的溶质有和;
(2)加入H2SO4调节pH的目的为;
(3)得到滤渣Ⅲ的“系列操作”的步骤为、过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42﹣有8/9转化为Cr2O72﹣ , 求转化后所得溶液中c(Cr2O72﹣)=molL﹣1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2 , 再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5 , 则发生反应的化学方程式为 .