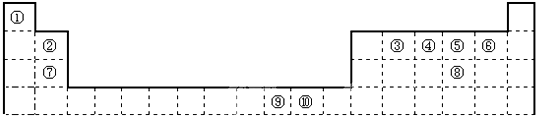
题目内容
9.A与B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol.L-1.反应进行2min后,A的浓度为0.8mol.L-1,B的浓度为0.6mol.L-1 C的浓度为0.6mol.L-1(1)2min内反应的平均反应速率为:ν(A)=0.1mol/(L.min)
(2)ν(A)、ν(B)、ν(C) 三者之间的关系是:ν(A):ν(B):ν(C)=1:2:3
(3)该反应的化学反应方程式:A+2B=3C.
分析 根据v=$\frac{△c}{△t}$计算v(A)、v(B)、v(C),速率之比等于其化学计量数之比,进而确定化学计量数,书写化学方程式;
解答 解:v(A)=$\frac{1mol/L-0.8mol/L}{2min}$=0.1mol/(L.min),
v(B)=$\frac{1mol/L-0.6mol/L}{2min}$=0.2mol/(L.min),
v(C)=$\frac{0.6mol/L}{2min}$=0.3mol/(L.min),
故ν(A):ν(B):ν(C)=0.1mol/(L.min):0.2mol/(L.min):0.3mol/(L.min)=1:2:3,
速率之比等于其化学计量数之比,故反应方程式为:A+2B=3C,
故答案为:(1)0.1mol/(L.min);
(2)ν(A):ν(B):ν(C)=1:2:3;
(3)A+2B=3C.
点评 本题考查化学反应速率有关计算,比较基础,注意对速率规律的理解与灵活应用.

练习册系列答案
相关题目
17.下列关于有机化合物的叙述中不正确的是( )
| A. | 丙烷跟甲烷一样能与氯气发生取代反应 | |
| B. | 1 mol乙酸与乙醇在一定条件下发生酯化反应,可生成1 mol乙酸乙酯 | |
| C. | CH2Cl2是纯净物说明甲烷是四面体结构而不是正方形结构 | |
| D. | 溴水既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 |
4.常温下,pH为3的FeCl3溶液,pH为11的Na2CO3溶液和pH为3的盐酸中由水电离出来的H+的浓度分别为:C1、C2、C3,它们之间的关系是( )
| A. | C1<C2<C3 | B. | C1=C2>C3 | C. | C1>C2>C3 | D. | 无法判断 |
14.下列溶液中的Cl-浓度与50mL1mol•L一1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 150 mL 1 mol•L-1NaCl溶液 | B. | 75 mL 2 mol•L-l CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1KCl溶液 | D. | 75 mL 1 mol•L-1 AlCl3溶液 |
1.下列各组物质中,不管它们以何种比例混合,只要总物质的量一定,充分燃烧后生成的二氧化碳的量和水的量均不变的是( )
| A. | 乙炔和苯 | B. | 乙醇和丙醇 | ||
| C. | 乙醇和乙醚(C2H5OC2H5) | D. | 乙醇和乙烷 |
18.下列分子和离子中,中心原子价层电子对的几何构型为四面体且分子或离子的空间构型为V形的是( )
| A. | OF2 | B. | SO2 | C. | H3O+ | D. | NH${\;}_{4}^{+}$ |
19.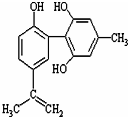 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是( )| A. | 该物质的分子式为C16H15O3 | |
| B. | 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 | |
| C. | 该分子中的所有碳原子不可能共平面 | |
| D. | 1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol 和7mol |