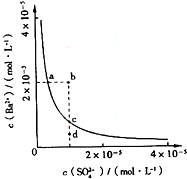
题目内容
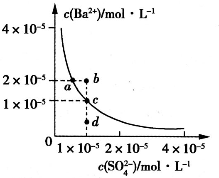 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.请回答下列问题:
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.请回答下列问题:(1)下列说法正确的是
C
C
(填序号).A.向BaSO4饱和溶液中加入固体Na2SO4可以由a点变到b点
B.通过蒸发可以由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(2)将100mL 1mol?L-1H2SO4溶液加入100mL含Ba2+0.137g的溶液中充分反应后,过滤,滤液中残留的Ba2+的物质的量浓度约为
2.02×10-10mol/L
2.02×10-10mol/L
.(3)若沉淀分别用100mL纯水和100mL0.01mol?L-1的H2SO4溶液洗涤,两种情况下损失的BaSO4的质量之比为
1000:1
1000:1
.分析:(1)该图中的是平衡曲线,线上的任意点都是平衡状态,b和d不是平衡状态,
A、加人Na2SO4后平衡逆向移动,但仍在线上移动;
B、蒸发使离子浓度增大,d点不可能到c点;
C、d点表示Qc<Ksp,溶液不饱和;
D、Ksp与温度有关,a和c的Ksp相等;
(2)根据硫酸根离子与钡离子的反应,求出剩余的硫酸根离子浓度,再根据Ksp计算;
(3)利用离子对溶解平衡的影响及Ksp(BaSO4)来计算溶解的硫酸钡的质量,然后确定两种洗涤方法中BaSO4沉淀的损耗量之比.
A、加人Na2SO4后平衡逆向移动,但仍在线上移动;
B、蒸发使离子浓度增大,d点不可能到c点;
C、d点表示Qc<Ksp,溶液不饱和;
D、Ksp与温度有关,a和c的Ksp相等;
(2)根据硫酸根离子与钡离子的反应,求出剩余的硫酸根离子浓度,再根据Ksp计算;
(3)利用离子对溶解平衡的影响及Ksp(BaSO4)来计算溶解的硫酸钡的质量,然后确定两种洗涤方法中BaSO4沉淀的损耗量之比.
解答:解:(1)A、硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO42-),平衡左移,c(Ba2+)应降低,故A错误;
B、d点时溶液不饱和,蒸发溶剂水,c(SO42-)、c(Ba2+)均增大,故B错误;
C、d点表示Qc<Ksp,溶液不饱和,不会有沉淀析出,故C正确;
D、Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故D错误;
故答案为:C;
(2)由图象可知Ksp(BaSO4)=10-5×10-5=10-10,将100mL 1mol?L-1H2SO4溶液加入100mL含Ba2+0.137g的溶液中充分反应后,反应生成BaSO4,硫酸根离子过量,加入n(Ba2+)=
=0.001mol,剩余的硫酸根离子的浓度为:c(SO42-)=
=0.495mol/L,所以剩余的钡离子为:c(Ba2+)=
=
=2.02×10-10mol/L,
故答案为:2.02×10-10mol/L;
(3)用100mL蒸馏水洗涤沉淀时,溶解的BaSO4的物质的量为0.1L×c(Ba2+)=0.1L×
mol/L=0.1L×
mol/L=10-6mol,
用100mL 0.01mol?L-1H2SO4溶液洗涤时,硫酸根离子抑制了沉淀的溶解,则溶解的BaSO4的物质的量为0.1L×c(Ba2+)=0.1L×
mol/L=10-9mol,
由同种物质的质量之比等于物质的质量之比,则两种洗涤方法中BaSO4沉淀的损耗量之比为10-6mol:10-9mol=1000:1,
所以两种情况下损失的BaSO4的质量之比为1000:1,
故答案为:1000:1.
B、d点时溶液不饱和,蒸发溶剂水,c(SO42-)、c(Ba2+)均增大,故B错误;
C、d点表示Qc<Ksp,溶液不饱和,不会有沉淀析出,故C正确;
D、Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故D错误;
故答案为:C;
(2)由图象可知Ksp(BaSO4)=10-5×10-5=10-10,将100mL 1mol?L-1H2SO4溶液加入100mL含Ba2+0.137g的溶液中充分反应后,反应生成BaSO4,硫酸根离子过量,加入n(Ba2+)=
| 0.137g |
| 137g/mol |
| 0.1×1-0.001 |
| 2 |
| Ksp(BaSO4) |
| c(SO42-) |
| 10-10 |
| 0.495 |
故答案为:2.02×10-10mol/L;
(3)用100mL蒸馏水洗涤沉淀时,溶解的BaSO4的物质的量为0.1L×c(Ba2+)=0.1L×
| Ksp(BaSO4) |
| 10-10 |
用100mL 0.01mol?L-1H2SO4溶液洗涤时,硫酸根离子抑制了沉淀的溶解,则溶解的BaSO4的物质的量为0.1L×c(Ba2+)=0.1L×
| Ksp |
| 0.01 |
由同种物质的质量之比等于物质的质量之比,则两种洗涤方法中BaSO4沉淀的损耗量之比为10-6mol:10-9mol=1000:1,
所以两种情况下损失的BaSO4的质量之比为1000:1,
故答案为:1000:1.
点评:本题考查沉淀溶解平衡,题目难度中等,注意理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积KSP的概念.

练习册系列答案
相关题目
 (2008?山东)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
(2008?山东)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( ) 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )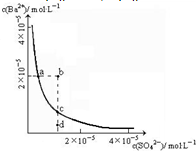 BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).
BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).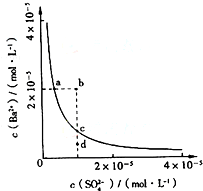 (2013?鹿城区模拟)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
(2013?鹿城区模拟)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )