题目内容
氮有多种氧化物,其中N2O3很不稳定,在液体或蒸汽中大部分都离解为NO和NO2,因而在NO转化为NO2的过程中几乎没有N2O3生成。亚硝酸也不稳定,在微热甚至冷的条件下也会分解。亚硝酸钠(NaNO2)在中性或碱性溶液中是稳定的,酸化后能氧化碘化钾生成单质碘和NO。请填写下列空白:
(1)写出亚硝酸分解的化学方程式:___________________________________。
(2)写出在酸性溶液中用亚硝酸钠和碘化钾反应制取NO的离子方程式:______________________。
(3)在隔绝空气的条件下按以下操作制取NO:先取亚硝酸钠溶液适量,加入稀盐酸,片刻后,再加入碘化钾溶液,此时,所得气体是否纯净?___________,原因是_______________,应该怎样进行操作才能得到纯净的NO?__________________________________________________________________________。
(1)2HNO2=NO↑+NO2↑+H2O
(2)
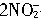 +2I-+4H+=2NO↑+I2+2H2O
+2I-+4H+=2NO↑+I2+2H2O(3)不纯净;由于加入KI溶液之前生成的HNO2部分分解,生成了NO和NO2,所以制得的NO气体中会混有NO2气体;取亚硝酸钠溶液适量,先加入KI溶液,后加入稀盐酸
【试题分析】

 备战中考寒假系列答案
备战中考寒假系列答案(12分)
A.原子数相同、电子总数相同的分子,互称为等电子体。
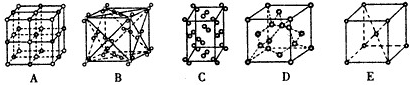
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
| | | A-B | A=B | A≡B |
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 | |||
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为 _____ 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ____(填晶体类型);Fe(CO)5是配合物,配体是__________ 。
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、 ___、 ____ 等仪器。
步骤2中,改用试剂 _______ (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是 。
步骤3中,滴定过程中,眼睛应注视 ____________________,被滴定的20 mL滤液中含CO32-的物质的量为 __ mol,试计算原500g茶叶中钙离子的质量分数为 _______ ,计算过程如下:
氮有多种氧化物,其中N2O5是一种新型硝化剂,其性质和制备收到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)
 4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氩气,则N2O5的转化率将___(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
|
t/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L—1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为______________。
③一定温度下,在2L恒容密闭容器中加入2mol
N2O5,达到平衡时,气体的压强为原来的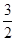 ,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K=_______。
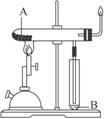
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的__________区生成,其电极反应式为_________________________________。

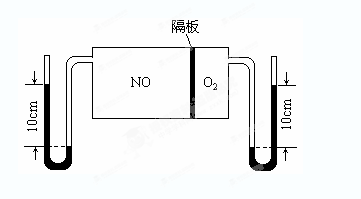
(3)如图:V(NO):V(O2)=3:1。当抽去NO和O2之间的隔板后,NO和O2反应后成NO2,部分NO2聚合成N2O4(N2O4此时为气态)。当体系达到平衡后,U形毛细管两端汞面高度差由反应前10cm变为7.1cm。假设温度不变,且隔板及U形毛细管的体积都忽略不计,此时混合气体的平均相对分子质量为__________。
 (1)氧元素与多种元素具有亲和力,所形成化合物的种类很多.
(1)氧元素与多种元素具有亲和力,所形成化合物的种类很多.