题目内容
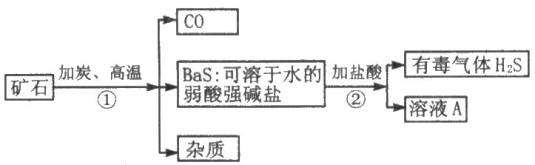
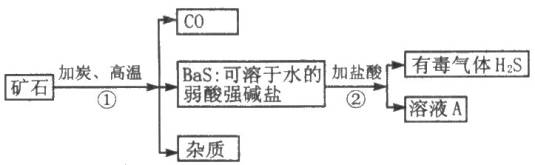
自然界矿物重晶石的主要成分是硫酸钡,它不溶于水,也不溶于任何一种酸和碱,纯净的硫酸钡可供医疗等方面应用.某课外活动小组的同学用重晶石矿和焦炭为原料制取纯净的硫酸钡,部分流程如图所示(假设矿物中杂质不与焦炭反应):请按要求填空:

(1)在步骤①中化合价升高的元素为________,化合价降低的元素为________;溶液A的溶质的化学式为________.
(2)写出用溶液A制取Ba(OH)2的化学方程式:________.
(3)某同学指出:上述步骤②产生了有毒气体硫化氢,应将方法改进.请你给出改进意见,使该实验不产生硫化氢气体,又能获得纯净的硫酸钡,并请写出有关的化学方程式:________.
答案:
解析:
解析:
|
(1)碳(或C)硫(或S)BaCl2 (2)BaCl2+2H2O 或BaCl2+Na2CO3=BaCO3↓+2NaCl BaCO3 (其他合理制法均可) (3)BaS+CuCl2=BaCl2+CuS↓, BaCl2+Na2SO4=2NaCl+BaSO4↓, 将BaS中S2-以沉淀形式除去. |

练习册系列答案
相关题目
 Ba(OH)2+Cl2↑+H2↑
Ba(OH)2+Cl2↑+H2↑ BaO+CO2↑,BaO+H2O=Ba(OH)2
BaO+CO2↑,BaO+H2O=Ba(OH)2