题目内容
0°C、1.01×105Pa条件下,ag气体X与bg气体Y的分子数相同,下列说法错误的是( )A.标准状况下,等质量的X和Y的体积比是b:a
B.同温同压下,气体X和气体Y的密度比是b:a
C.25°C时,1g气体X和气体Y的分子数之比是b:a
D.同物质的量的气体X和气体Y的质量比是a:b
【答案】分析:相同条件下,ag气体X与bg气体Y的分子数相同,二者的物质的量相同,故二者摩尔质量之比为a:b,
A、相同条件下,等质量的X和Y的体积之比与摩尔质量成反比;
B、相同条件下,密度之比等于摩尔质量之比;
C、相同条件下,等质量的X和Y的分子数目之比与摩尔质量成反比;
D、相同物质的量,质量之比等于摩尔质量之比.
解答:解:相同条件下,ag气体X与bg气体Y的分子数相同,二者的物质的量相同,故二者摩尔质量之比为a:b,
A、相同条件下,等质量的X和Y的体积之比与摩尔质量成反比,故等质量的X和Y的体积比是b:a,故A正确;
B、相同条件下,密度之比等于摩尔质量之比,故同温同压下,气体X和气体Y的密度比是a:b,故B错误;
C、相同条件下,等质量的X和Y的分子数目之比与摩尔质量成反比,故1g气体X和气体Y的分子数之比是b:a,故C正确;
D、相同物质的量,质量之比等于摩尔质量之比,故同物质的量的气体X和气体Y的质量比是a:b,故D正确;
故选B.
点评:本题考查阿伏伽德罗定律及推论,难度中等,注意根据pV=nRT理解阿伏伽德罗定律及推论.
A、相同条件下,等质量的X和Y的体积之比与摩尔质量成反比;
B、相同条件下,密度之比等于摩尔质量之比;
C、相同条件下,等质量的X和Y的分子数目之比与摩尔质量成反比;
D、相同物质的量,质量之比等于摩尔质量之比.
解答:解:相同条件下,ag气体X与bg气体Y的分子数相同,二者的物质的量相同,故二者摩尔质量之比为a:b,
A、相同条件下,等质量的X和Y的体积之比与摩尔质量成反比,故等质量的X和Y的体积比是b:a,故A正确;
B、相同条件下,密度之比等于摩尔质量之比,故同温同压下,气体X和气体Y的密度比是a:b,故B错误;
C、相同条件下,等质量的X和Y的分子数目之比与摩尔质量成反比,故1g气体X和气体Y的分子数之比是b:a,故C正确;
D、相同物质的量,质量之比等于摩尔质量之比,故同物质的量的气体X和气体Y的质量比是a:b,故D正确;
故选B.
点评:本题考查阿伏伽德罗定律及推论,难度中等,注意根据pV=nRT理解阿伏伽德罗定律及推论.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=______.已知:K300°C>K350°C,则该反应是______热反应.
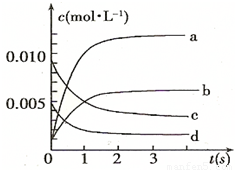
(2)如图中表示NO2的变化的曲线是______;用O2表示从0~2s内该反应的平均速率v=______.
(3)能说明该反应已达到平衡状态的是______.
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是______.
A.及时分离除NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂.
| 时间(s) | 1 | 2 | 3 | 4 | |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是______;用O2表示从0~2s内该反应的平均速率v=______.
(3)能说明该反应已达到平衡状态的是______.
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是______.
A.及时分离除NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂.

合成氨对化学工业和国防工业具有重要意义.
(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为TC时平衡混合物中氨气的体积分数与压强(P)的关系图.

①写出工业上合成氨的化学方程式 .
②图A中氨气的体积分数为15.00%时,H2的转化率= .
③图B中T=500°C,温度为450C对应的曲线是 (选填字母“a“或“b”),选择的理由是
④由图象知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是 (写出一条即可).
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
(3)一定温度下,在2L容器中发生上述反应,各物质的物质的量变化如下表
①分析表中数据,判断5?7min之间反应是否处于平衡状态 (填“是”或“否”),
前5min平均反应速率v(CH4)= .
②反应在7~10min之间,CO的物质的量减少的原因可能是 (填字母).
a?减少CH4 b?降低温度c?增大压强d?充入H2
③若保持温度不变,向1L容器中起始充入0.15mol CH4.0.45mol H2O. mol CO、 mol H2,达到平衡时CH4的体积百分含量与第一次投料相同.
(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为TC时平衡混合物中氨气的体积分数与压强(P)的关系图.

①写出工业上合成氨的化学方程式 .
②图A中氨气的体积分数为15.00%时,H2的转化率= .
③图B中T=500°C,温度为450C对应的曲线是 (选填字母“a“或“b”),选择的理由是
④由图象知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是 (写出一条即可).
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
CH4(g)+H2O
 CO(g)+3H2(g);△H=+QkJ/mol(Q>0)
CO(g)+3H2(g);△H=+QkJ/mol(Q>0)(3)一定温度下,在2L容器中发生上述反应,各物质的物质的量变化如下表
| 时间/min | CH4(mol) | H20( mol) | CO (mol) | H2 (mol) |
| 0.40 | 1.00 | |||
| 5 | X1 | X2 | X3 | 0.60 |
| 7 | Y1 | Y2 | 0.20 | Y3 |
| 10 | 0.21 | 0.81 | 0.19 | 0.62 |
前5min平均反应速率v(CH4)= .
②反应在7~10min之间,CO的物质的量减少的原因可能是 (填字母).
a?减少CH4 b?降低温度c?增大压强d?充入H2
③若保持温度不变,向1L容器中起始充入0.15mol CH4.0.45mol H2O. mol CO、 mol H2,达到平衡时CH4的体积百分含量与第一次投料相同.
 O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1则表示液态甲醇燃烧热的热化学方程式为______.
O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1则表示液态甲醇燃烧热的热化学方程式为______.