题目内容
下列离子方程式,正确的是
| A.氢氧化铁与盐酸反应:H++OH-=H2O |
| B.CaCO3溶于稀盐酸中:CO32-+2H+=CO2↑+H2O |
| C.铁与H2SO4反应:Fe+2H+=Fe3++H2↑ |
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO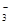 +Ca2++OH-= CaCO3↓+H2O +Ca2++OH-= CaCO3↓+H2O |
D
试题分析:氢氧化铁与盐酸反应反应生成氯化铁和水,离子反应为Fe(OH)3+3H+═Fe3++3H2O,故A错误;CaCO3溶于稀盐酸中反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,故B错误;铁与H2SO4反应的离子方程式为:Fe+2H+=Fe2++H2↑,故C错误;Ca(HCO3)2溶液与少量NaOH溶液反应:HCO
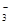 +Ca2++OH-= CaCO3↓+H2O,故D正确。
+Ca2++OH-= CaCO3↓+H2O,故D正确。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。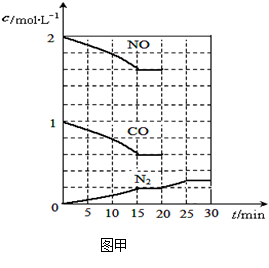
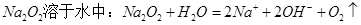

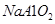 溶液中通入过量
溶液中通入过量
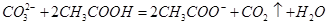
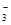 = 3Fe2+ + 2NO↑ + 4H2O
= 3Fe2+ + 2NO↑ + 4H2O Al(OH)3↓ + 3/2H2↑ + 3/2Cl2↑
Al(OH)3↓ + 3/2H2↑ + 3/2Cl2↑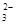 + 2CH3COOH = 2CH3COO- + H2O + CO2↑
+ 2CH3COOH = 2CH3COO- + H2O + CO2↑ (橙)+ H2O
(橙)+ H2O  2CrO
2CrO (黄)+2H+
(黄)+2H+ NH3↑+ H2O
NH3↑+ H2O