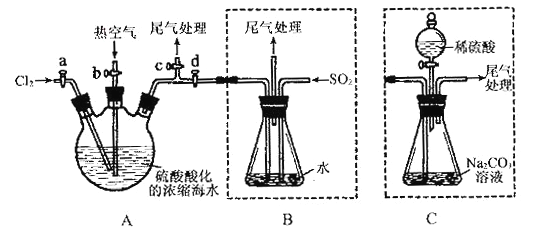
��Ŀ����
����Ŀ������Ԫ�ض����γɶ������ʣ����ǿ���������ѧ���ʽṹ�����ʵ����֪ʶȡ��ʶ�����⡣
��1����̬��ԭ�ӵļ۵����Ų�ʽΪ_____������ſڴƻơ��еĴƻƷ���ʽΪAs2S3�����ӽṹ��ͼ ����Asԭ�ӵ��ӻ���ʽΪ_________��
����Asԭ�ӵ��ӻ���ʽΪ_________��
��2��N2��CO�ķ��ӽṹ���ƣ�1��CO�����к��еġǼ���Ŀ��_____����
��3��������ͭ��Һ��ͨ�������NH3�������ɿ����������[Cu(NH3)4]SO4��H2O���塣�þ��������ķǽ���Ԫ���У��縺��������_________����Ԫ�ط��ţ�����һ������������_________����Ԫ�ط��ţ��������Ҵ�������[Cu(NH3)4]SO4��H2O�����ԭ����________��
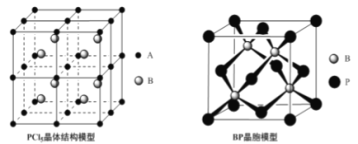
��4��������PCl5��һ�ְ�ɫ���壬��������ϵ����ṹģ��������ͼ��ʾ����A��B���������ɣ����������148���ۻ����γ�һ���ܵ�������塣��֪A����CCl4������ͬ�ռ乹�ͺͳɼ���ʽ����AΪ_________��BΪ__________��
��5������(BP)��һ�ֳ�Ӳ��ĥͿ����ϣ�����ͼΪ���������������е�ÿ��ԭ�Ӿ�����8�����ȶ��ṹ�����ж����۵�_______________(����ڡ����ڡ�)���ʯ�۵㡣��֪��B-P������Ϊx cm�������ܶ�Ϊ_______________ g�qcm-3(�г�����ʽ����)��
���𰸡� 4s24p3 sp3�ӻ� 2 O N �Ҵ����Ӽ��Ա�ˮ���Ӽ������������Ҵ������ܼ��ļ��ԣ��Ӷ���С���ʵ��ܽ�� PCl4+ PCl4- ���� 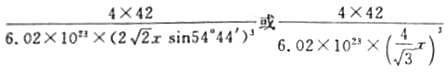
����������1����̬��ԭ�ӵĵ����Ų�ʽΪ[Ar]3d104s24p3������۵����Ų�ʽΪ4s24p3��As�������5�����ӣ��γ�3�����ۼ����ļ����Ӷ���Ϊ3�������1���µ��Ӷԣ�����As���ӻ���ʽΪp3�ӻ�����2��CO�Ľṹ���Ա�ʾΪ![]() ��������Բ���ʾ�Ǽ�����1��CO�����к��еġǼ���Ŀ��2������3�������[Cu(NH3)4]SO4��H2O���������ķǽ���Ԫ����N��H��S��OԪ�أ����зǽ�������ǿ����OԪ�أ���縺��������O��NԪ��ԭ�ӵ�2p���Ϊ���������һ����������Ҵ����Ӽ��Ա�ˮ���Ӽ������������Ҵ������ܼ��ļ��ԣ��Ӷ���С���ʵ��ܽ�ȣ�����[Cu(NH3)4]SO4��H2O���壻��4��A����CCl4������ͬ�ռ乹����Ӧ��ԭ������һ����5��ԭ���Ҽ۵���������ͬΪ32������Ӧ�ô�һ����λ����ɵ�PCl4+���ӣ���BΪ������ɵ�PCl4-���ӣ���5�����ʯ�������嶼��ԭ�Ӿ��壬����ԭ�ӵİ뾶��̼ԭ�Ӵ�C��C���ۼ�������B��PС�����ܴ������������۵�Ҫ�Ƚ��ʯ�ĵͣ� Pλ�ڶ�������ģ����P�ĸ���Ϊ8��1/8��6��1/2=4��Bλ�����ģ���4���������Ļ�ѧʽΪBP����˾���������Ϊ4��42/NAg��B��P�ļ���Ϊx������Խ���Ϊ1/4������Խ���Ϊ4x����˾����ı߳�Ϊ
��������Բ���ʾ�Ǽ�����1��CO�����к��еġǼ���Ŀ��2������3�������[Cu(NH3)4]SO4��H2O���������ķǽ���Ԫ����N��H��S��OԪ�أ����зǽ�������ǿ����OԪ�أ���縺��������O��NԪ��ԭ�ӵ�2p���Ϊ���������һ����������Ҵ����Ӽ��Ա�ˮ���Ӽ������������Ҵ������ܼ��ļ��ԣ��Ӷ���С���ʵ��ܽ�ȣ�����[Cu(NH3)4]SO4��H2O���壻��4��A����CCl4������ͬ�ռ乹����Ӧ��ԭ������һ����5��ԭ���Ҽ۵���������ͬΪ32������Ӧ�ô�һ����λ����ɵ�PCl4+���ӣ���BΪ������ɵ�PCl4-���ӣ���5�����ʯ�������嶼��ԭ�Ӿ��壬����ԭ�ӵİ뾶��̼ԭ�Ӵ�C��C���ۼ�������B��PС�����ܴ������������۵�Ҫ�Ƚ��ʯ�ĵͣ� Pλ�ڶ�������ģ����P�ĸ���Ϊ8��1/8��6��1/2=4��Bλ�����ģ���4���������Ļ�ѧʽΪBP����˾���������Ϊ4��42/NAg��B��P�ļ���Ϊx������Խ���Ϊ1/4������Խ���Ϊ4x����˾����ı߳�Ϊ![]() cm�������ܶȵĶ��壬�������ܶ�Ϊ
cm�������ܶȵĶ��壬�������ܶ�Ϊ g/cm3��
g/cm3��