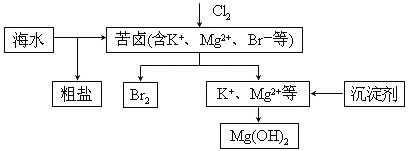
题目内容
【题目】Ⅰ. A、B、C、D、E均为中学化学常见的纯净物,B为最常见的液体,它们之间有如下反应关系:
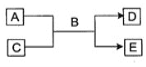
(1)若A为短周期的金属单质,D为气态单质,0.1 mol/L-1 C溶液的pH=13,则该反应的离子方程式为____________。
(2)若A的水溶液能使淀粉溶液变蓝,C为非金属氧化物,且能使品红溶液褪色,则该反应的化学方程式为___________。
(3)若A、C、D、E均为化合物,E为白色絮状沉淀,且A、C、E均含有同一种元素,则该反应的离子方程式为 ___________。
Ⅱ.(1)二氧化氯是目前国际上公认的第四代高效、无毒的光谱消毒剂,它可由KClO3和H2SO4存在下与Na2SO3反应制得。请写出该反应的离子反应方程式: ___________。
(2)过碳酸钠是一种有多种用途的新型氧系固定漂白剂,化学式可表示为Na2CO33H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是_________。
A. MnO2 B. KMnO4溶液 C. 稀盐酸 D. Na2SO3溶液
【答案】2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑ 或 2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2↑ I2 + SO2 + 2H2O = 2HI+ H2SO4 Al3+ + 3 AlO2- + 6H2O = 4Al(OH)3↓ 2ClO3- + SO32- + 2H+ = SO42- + 2ClO2 + H2O D
【解析】
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,判断为H2O;
(1)以“0.1mol/L C溶液的pH=13”为突破口,说明C为强碱性溶液,若A为短周期的金属单质,高中阶段唯有金属铝可以与强碱反应生成气体,据此推断分析;
(2)能使淀粉溶液变蓝的物质为碘单质,二氧化硫可使品红褪色,据此分析判断;
(3)考查铝三角的转化,若A、C、D、E均为化合物,E为白色沉淀,且A、C、E含有同一种元素,则A为氯化铝,C为偏铝酸钠,E为Al(OH)3、D为氯化钠;
Ⅱ.(1)二氧化氯由KClO3在H2SO4存在下与Na2SO3反应制得,则可知反应物、生成物,结合电子守恒、电荷守恒分析;
(2)Na2CO33H2O2具有Na2CO3和H2O2的双重性质,过碳酸钠只发生了还原反应,则选项中的物质具有还原性。
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,判断为H2O;(1)若A为短周期的金属单质,0.1mol/L C溶液的pH=13,说明C为强碱性溶液,D为气态单质,判断A为Al,D为H2,该反应的离子方程式为2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑ 或 2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2↑,
故答案为:2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑或 2Al + 2OH- + 6H2O = 2[Al(OH)4]- + 3H2↑;
(2)若A的溶液能使淀粉溶液变蓝,A具有氧化性,C为非金属氧化物,能使品红溶液褪色,则C为二氧化硫,则A为碘,该反应的反应方程式为I2 + SO2 + 2H2O = 2HI+ H2SO4,
故答案为:I2 + SO2 + 2H2O = 2HI+ H2SO4;
(3)若A、C、D、E均为化合物,E为白色沉淀,且A、C、E含有同一种元素,则A为氯化铝,C为偏铝酸钠,E为Al(OH)3、D为氯化钠,该反应的离子方程式为Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓,
故答案为:Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓;
Ⅱ.(1)KClO3在H2SO4存在下与Na2SO3反应,SO32被氧化成SO42,由电子、电荷守恒可知该离子反应为2ClO3- + SO32- + 2H+ = SO42- + 2ClO2 + H2O,
故答案为:2ClO3- + SO32- + 2H+ = SO42- + 2ClO2 + H2O;
(6)Na2CO33H2O2具有Na2CO3和H2O2的双重性质,过碳酸钠只发生了还原反应,则选项中的物质具有还原性,只有D选项符合,
故答案为:D。

【题目】某学生通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L 的盐酸与50mL0.55mol/L 的 NaOH 溶液在如图所示的装置中进行中和反应。 请回答下列问题:
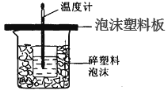
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_________;由图可知该装 置有不妥之处,应如何改正?_____。
(2)实验中改用 60 mL0.50 mol/L 的盐酸跟 50mL 0.55 mol/L 的 NaOH 溶液进行反应,与 上述实验相比,所放出的热量_____(填“相等”或“不相等”);所求中和热的数值会_____(填“相等”或 “不相等”),理由是_____。
(3)该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因 是_____。
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 C.做本实验的当天室温较高 D.在量取盐酸时仰视计数
E.将 50mL0.55mol/L 氢氧化钠溶液取成了 50mL0.55mol/L 的氨水
(4)将 V1ml 1.0mol/L HCl 溶液和 V2ml 未知浓度的 NaOH 溶液混合均匀后测量并记录温 度,实验结果如下图所示(实验中始终保持 V1+V2=50mL)
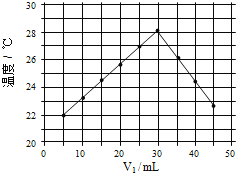
通过分析图像可知,做该实验时环境温度_____(填“高于”,“低于”或“等于”)22℃,该 NaOH 溶液的浓度约为_____mol/L。
(5)假设盐酸和氢氧化钠溶液的密度都是 1g·cm-3,又知中和反应后生成溶液的比热容 c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度 t1/℃ | 终止温度 t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=_____(结果保留一位小数)。