题目内容
已知25℃、101kPa条件下:
①4Al(s)+3O2(g)═2Al2O3(s);△H=-2834.9kJ?mol-1
②4Al(s)+2O3(g)═2Al2O3(s);△H=-3119.1kJ?mol-1 由此得出的正确结论是( )
①4Al(s)+3O2(g)═2Al2O3(s);△H=-2834.9kJ?mol-1
②4Al(s)+2O3(g)═2Al2O3(s);△H=-3119.1kJ?mol-1 由此得出的正确结论是( )
| A、等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B、反应①可确定铝的燃烧热是708.7KJ |
| C、O3比O2稳定,由O2变O3为放热反应 |
| D、反应②可确定铝的燃烧热是779.78kJ?mol-1 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:利用盖斯定律,将反应①-②得:3O2(g)=2O3(g);△H=+284.2KJ/mol,可知等质量的氧气比臭氧能量低,物质的能量越低越稳定;燃烧热是指1mol物质与氧气完全燃烧时放出的热量,据此解答.
解答:
解:利用盖斯定律,将反应①-②得:3O2(g)=2O3(g);△H=+284.2KJ/mol,可知等质量的氧气比臭氧能量低,物质的能量越低越稳定;燃烧热是指1mol物质与氧气完全燃烧时放出的热量,
A、利用盖斯定律,将反应①-②得:3O2(g)=2O3(g);△H=+284.2KJ/mol,可知等质量的氧气比臭氧能量低,故A正确;
B、据反应①可知,4molAl与氧气反应放热2834.9KJ,则1molAl燃烧放热708.7KJ,Al的燃烧热为708.7KJ/mol,燃烧热的单位不对,故B错误;
C、利用盖斯定律,将反应①-②得:3O2(g)=2O3(g);△H=+284.2KJ/mol,可知等质量的氧气比臭氧能量低,物质的能量越低越稳定,故C错误;
D、燃烧热是指1mol物质与氧气完全燃烧时放出的热量,不是与臭氧燃烧,故D错误;
故选:A.
A、利用盖斯定律,将反应①-②得:3O2(g)=2O3(g);△H=+284.2KJ/mol,可知等质量的氧气比臭氧能量低,故A正确;
B、据反应①可知,4molAl与氧气反应放热2834.9KJ,则1molAl燃烧放热708.7KJ,Al的燃烧热为708.7KJ/mol,燃烧热的单位不对,故B错误;
C、利用盖斯定律,将反应①-②得:3O2(g)=2O3(g);△H=+284.2KJ/mol,可知等质量的氧气比臭氧能量低,物质的能量越低越稳定,故C错误;
D、燃烧热是指1mol物质与氧气完全燃烧时放出的热量,不是与臭氧燃烧,故D错误;
故选:A.
点评:本题主要考查了盖斯定律的应用、物质的能量越低越稳定、燃烧热的概念、单位,题目难度一般.

练习册系列答案
相关题目
一定条件下存在反应:A(g)+B(g)?C(g)+D(g)△H<0.现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol A和1mol B,在Ⅱ中充入1mol C和1mol D,在Ⅲ中充入2mol A和2mol B,500℃条件下开始反应.达到平衡时,下列说法正确的是( )
| A、容器Ⅰ、Ⅱ中正反应速率相同 |
| B、容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C、容器Ⅰ中A的物质的量比容器Ⅱ中的多 |
| D、容器Ⅰ中A的转化率与容器Ⅱ中C的转化率之和小于1 |
下列关于钠、镁、铝性质说法正确的是( )
| A、铝的金属性最强 |
| B、镁的原子半径最大 |
| C、它们的最高价氧化物的水化物中,只有NaOH属于强碱 |
| D、铝的最高价是+3价,最低价是-5价 |
下列说法正确的是( )
| A、原子晶体中只存在非极性共价键 |
| B、稀有气体形成的晶体属于分子晶体 |
| C、干冰升华时,分子内共价键会发生断裂 |
| D、金属元素和非金属元素形成的化合物一定是离子化合物 |
下列说法正确的是( )
| A、第ⅠA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈 |
| B、第二周期元素的最高正价和最低负价的绝对值之和等于8 |
| C、同周期主族元素的原子形成简单离子的电子层结构相同 |
| D、第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
既能与稀硫酸反应,又能与NaOH溶液反应,且都有气体放出的是( )
| A、NaHCO3 |
| B、(NH4)2CO3 |
| C、Al(OH)3 |
| D、Al2O3 |
如图是两种致癌物质的结构简式,以下的描述正确的是( )
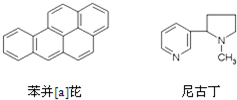

| A、它们都属于烃 |
| B、苯并[a]芘的分子式是C20H12 |
| C、尼古丁的分子式是C10H13N2 |
| D、苯并[a]芘的分子是由5个苯的结构单元并合而成,所以它是苯的同系物 |
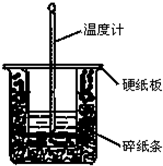 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: