题目内容
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法不正确的是
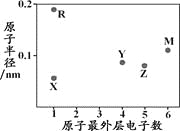
A. R的氧化物都含有离子键
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. Y形成的化合物种类最多
【答案】B
【解析】试题分析:X、Y、Z、M、R为五种短周期元素,X、R最外层只有一个电子,为第IA族元素;Y最外层有4个电子,位于第IVA族,Z原子最外层有5个电子,位于第VA族,M最外层有6个电子,位于第VIA族;R原子半径最大,为Na元素,X原子半径最小,为H元素;Y原子和Z原子半径接近、M原子半径大于Y而最外层电子数大于Y,所以Y是C、Z是N、M为S元素;A.氧化钠、过氧化钠中均含有离子键,A正确;B.元素的非金属性越强,其最高价含氧酸的酸性越强,非金属性Z>Y,所以其最高价含氧酸酸性Z>Y,B错误;C.M的氢化物的硫化氢,常温下为气体,C正确;D.有机物均含有碳元素,则碳元素形成的化合物最多,D正确;答案选B。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】
(1)写出醋酸在水溶液中的电离方程式 。若某温度下,CH3COOH(aq)与NaOH(aq)反应的△H=" -" 46.8kJ·mol-1,HCl(aq)与NaOH(aq)反应的△H=" -" 55.6 kJ·mol-1,则CH3COOH在水溶液中电离的△H= kJ·mol-1。
(2)某温度下,实验测得0.1mol·L-1醋酸电离度约为1.5%,则该温度下0.1mol·L-1CH3COOH的电离平衡常数K=________(列出计算式,已知电离度![]() )
)
(3)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:
![]()
下列描述能说明乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是 。
A.乙烯、乙酸、乙酸乙酯的浓度相同 |
B.酯化合成反应的速率与酯分解反应的速率相等 |
C.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol |
D.体系中乙烯的百分含量一定 |
(4)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
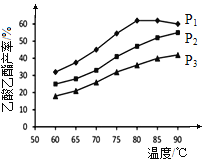
① 温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是 [用![]() (P1)、
(P1)、![]() (P2)、
(P2)、![]() (P3)分别表示不同压强下的反应速率],分析其原因为 。
(P3)分别表示不同压强下的反应速率],分析其原因为 。
②压强为P1MPa、温度60℃时,若乙酸乙酯的产率为30℅,则此时乙烯的转化率为 。
③在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是_________。
④根据测定实验结果分析,较适宜的生产条件是 (填出合适的压强和温度)。为提高乙酸乙酯的合成速率和产率,可以采取的措施有 (任写出一条)。