题目内容
下列多电子原子的原子轨道能量高低顺序正确的是( )
| A.2s>3s | B.2s>2d | C.2px<2Py | D.2px=2py |
A.形状相同的原子轨道能量的高低:1s<2s<3s<4s…,所以3s>2s,故A错误;
B.相同电子层上原子轨道能量的高低:ns<np<nd<nf,所以2s<2d,故B错误;
C.2px和2Py轨道是两个不同的原子轨道,空间伸展方向不同,两个轨道上的电子的运动状态不同,但同一能级上的原子轨道具有相同的能量,即2px=2py故C错误;
D.2px和2Py轨道是两个不同的原子轨道,空间伸展方向不同,两个轨道上的电子的运动状态不同,但同一能级上的原子轨道具有相同的能量,即2px=2py,故D正确;
故选:D.
B.相同电子层上原子轨道能量的高低:ns<np<nd<nf,所以2s<2d,故B错误;
C.2px和2Py轨道是两个不同的原子轨道,空间伸展方向不同,两个轨道上的电子的运动状态不同,但同一能级上的原子轨道具有相同的能量,即2px=2py故C错误;
D.2px和2Py轨道是两个不同的原子轨道,空间伸展方向不同,两个轨道上的电子的运动状态不同,但同一能级上的原子轨道具有相同的能量,即2px=2py,故D正确;
故选:D.

练习册系列答案
相关题目
 ;a与b形成化合物的电子式为:
;a与b形成化合物的电子式为: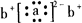 .
.