题目内容
【题目】某课外活动小组为探究金属与浓硫酸反应,进行了如下实验。
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示。(固定装置已略去)
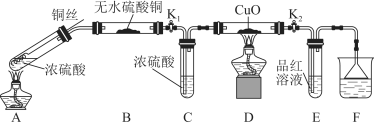
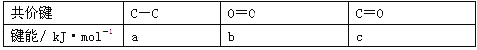
(1)A中反应的化学方程式为 。
(2)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是 。
Ⅱ.研究过量的锌与浓硫酸反应产生的气体:
(3)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是__________________;
(4)某同学用下列装置连接成一整套实验装置以验证(3)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是________________(用a、b……填写)。
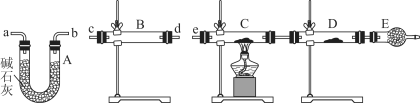
(5)根据(4)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:

①___________________________________________________________________________
②___________________________________________________________________________
③___________________________________________________________________________
④___________________________________________________________________________
⑤___________________________________________________________________________
【答案】
(1)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)D装置中黑色固体颜色无变化,E中溶液褪色
(3)氢气和水蒸气
(4)cd(或dc)ab(或ba)e
(5)①无水硫酸铜②固体由白色变成蓝色③SO2中含有水蒸气④固体由黑色变成红色⑤SO2中含有氢气
【解析】
试题分析:(1)碳和浓硫酸在加热条件下生成二氧化碳、二氧化硫和水,反应的化学方程式为:2H2SO4(浓)+Cu ![]() SO2↑+SO42-+Cu2++2H2O。
SO2↑+SO42-+Cu2++2H2O。
故答案为:2H2SO4(浓)+Cu![]() SO2↑+SO42-+Cu2++2H2O;
SO2↑+SO42-+Cu2++2H2O;
(2)由于D装置中黑色固体颜色无变化,E中溶液褪色,说明反应生成了二氧化硫,证明反应中S元素被还原,在反应中作氧化剂,而氢离子没有被还原,所以浓硫酸的中S的氧化性大于氢离子。
故答案为:D装置中黑色固体颜色无变化,E中溶液褪色;
(3)随着反应的进行浓硫酸被消耗会变成稀硫酸,锌与稀硫酸反应产生氢气,所以SO2中的杂质可能为H2和H2O(g)。
故答案为:氢气和水蒸气;
(4)先检验水的存在,将水除尽,再检验H2和CuO反应生成的水,B装置检验水,A装置除去气体中的水蒸气,C、D用于检验气体中是否含有H2,所以气流方向为:c d(或d c)a b(或b a)e。
故答案为:c d(或d c)a b(或b a)e;
(5)B装置检验水,装置内盛放无水硫酸铜,若固体由白色变成蓝色,说明SO2中含有水蒸气;
若含有H2,在装置C中发生反应H2+CuO![]() Cu+H2O,固体由黑色变成红色,D装置内固体由白色变成蓝色,说明SO2中含有氢气。
Cu+H2O,固体由黑色变成红色,D装置内固体由白色变成蓝色,说明SO2中含有氢气。
故答案为:①无水硫酸铜;②固体由白色变成蓝色;③SO2中含有水蒸气;④C装置中固体由黑色变成红色,D装置内固体由白色变成蓝色;⑤SO2中含有氢气。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案