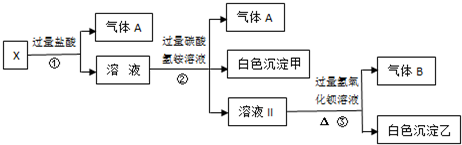
题目内容
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO 、MnO
、MnO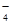 、CO
、CO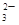 、SO
、SO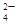 中的若干种离子组成,取溶液进行右图实验:
中的若干种离子组成,取溶液进行右图实验:
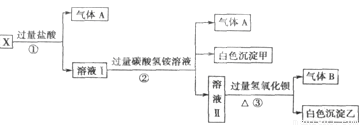
(1)白色沉淀甲是 。
(2)X溶液中一定存在的离子是 。
(3)白色沉淀乙中一定有: ,可能有 。
(4)若将过量的气体A与适量的气体B通入水中,写出反应的化学方程式 。
【答案】
(1)Al(OH)3
(2)Na+、Al3+、CO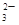
(3) BaCO3、 BaSO4
(4)NH3+CO2+H2O=NH4HCO3
【解析】
试题分析:MnO 为紫红色,不符合题意;加入过量盐酸有气体产生确定有CO
为紫红色,不符合题意;加入过量盐酸有气体产生确定有CO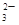 ,Ag+、Ba2+、Al3+与其不共存,溶液中不能存在;阳离子只有Na+,一定存在;加入碳酸氢铵,产生的气体是其与过量的盐酸反应生成的CO2,沉淀为氢氧化铝,即溶液中含有AlO
,Ag+、Ba2+、Al3+与其不共存,溶液中不能存在;阳离子只有Na+,一定存在;加入碳酸氢铵,产生的气体是其与过量的盐酸反应生成的CO2,沉淀为氢氧化铝,即溶液中含有AlO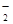 ,溶于过量的盐酸形成Al3+,进而与碳酸氢铵双水解,产生沉淀和气体;加入氢氧化钡气体为氨气,沉淀为BaSO4 或过量的碳酸氢铵与氢氧化钡反应生成的BaCO3,所以溶液一定含有Na+、Al3+、CO
,溶于过量的盐酸形成Al3+,进而与碳酸氢铵双水解,产生沉淀和气体;加入氢氧化钡气体为氨气,沉淀为BaSO4 或过量的碳酸氢铵与氢氧化钡反应生成的BaCO3,所以溶液一定含有Na+、Al3+、CO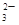 ,不能确定有SO
,不能确定有SO 。
。
考点:考查离子共存与离子检验有关问题。

练习册系列答案
相关题目

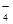 、CO
、CO 1)气体A的成分是:_________________,气体B的成分是_____________
1)气体A的成分是:_________________,气体B的成分是_____________