题目内容
【题目】锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
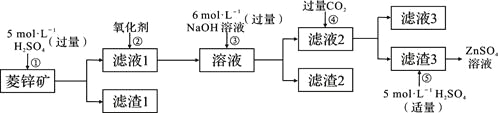
Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)②中使用的氧化剂最好是下列的___(选填字母代号)。
A.Cl2 B.浓HNO3 C.KMnO4 D.H2O2
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤_____(选填①、②、③、⑤)。
(3)写出步骤④后产生滤渣3的化学式______。
(4)与Al相似,Zn也能溶于NaOH溶液。写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式:______________________。
Ⅱ、BaS溶液的制备:
![]()
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
Ba(s)+S(s)=BaS(s) ΔH3=-460 kJ·mol-1
(5)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:______。
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是___。
【答案】D ① Zn(OH)2 Zn-2e-+4OH-=ZnO22-+2H2O BaSO4(s) +4C(s)=BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1 过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率
【解析】
根据菱锌矿的主要成分,加入硫酸后,SiO2与硫酸不反应,故滤渣1主要是SiO2,滤液1中的主要离子有Zn 2+、Fe2+、Cu2+,加入氧化剂,将Fe2+氧化成Fe3+,加入过量的NaOH溶液后Fe3+、Cu2+生成沉淀,由于Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2,所以滤液2的主要成分是Na2ZnO2,通入CO2与Na2ZnO2反应生成的滤渣3是Zn(OH)2,滤液3主要是NaHCO3。
(1)为了不引入新的杂质,氧化剂最好用H2O2,答案选D。
(2)步骤①中加入硫酸与ZnCO3、FeCO3、Cu2(OH)2CO3反应生成的CO2可提供给步骤④使用,故选①。
(3)根据分析滤渣3是Zn(OH)2。
(4)Zn片和Cu片放入NaOH溶液中形成原电池Zn片作负极,与OH-溶液反应生成ZnO22-,负极电极反应式为:Zn-2e-+4OH-=ZnO22-+2H2O。
(5)对题给热化学方程式编号
①Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
③Ba(s)+S(s)=BaS(s) ΔH3=-460 kJ·mol-1
若煅烧还原的产物仅为BaS和CO,化学方程式为:BaSO4(s) +4C(s)=BaS(s)+4CO(g),根据盖斯定律,将③+②×4-①得,BaSO4(s) +4C(s)=BaS(s)+4CO(g) ΔH=ΔH2×4+ΔH3-ΔH1=(-110.5kJ/mol)×4-460kJ/mol+1473.2kJ/mol=+571.2 kJ·mol-1。
(6)如果生产流程步骤⑤硫酸过量的话,过量的酸与BaS溶液混合会产生有毒的H2S污染空气,而且会降低锌钡白的产率。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】现有室温下四种溶液,有关叙述不正确的是( )
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液为碱性
D.VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11