题目内容
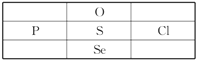
【题目】(1)200mL2mol/L的Al2(SO4)3溶液中SO42-的物质的量浓度为___;
(2)标准状况下,36gH2和O2组成的混合气体的体积是67.2L,则混合气体中H2和O2的体积比为___;
(3)标准状况下,将33.6LNH3溶于水配成500mL溶液,该溶液的物质的量浓度为___;
(4)已知1.505×1023个A气体分子的质量为31g,则A气体的摩尔质量是___。
【答案】6mol/L 2:1 3mol/L 124g/mol
【解析】
(1)2mol/L的Al2(SO4)3溶液中SO42-的物质的量浓度c(SO42-)=2mol/L×3=6mol/L,故答案为:6mol/L;
(2)标准状况下,67.2L的混合气体的物质的量为![]() ,36gH2和O2组成的混合气体的平均摩尔质量为
,36gH2和O2组成的混合气体的平均摩尔质量为![]() ,根据十字交叉
,根据十字交叉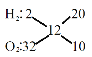 得到混合气体中H2和O2的体积比为20:10=2:1,故答案为:2:1;
得到混合气体中H2和O2的体积比为20:10=2:1,故答案为:2:1;
(3)标准状况下,33.6LNH3为![]() ,溶于水形成的氨水的浓度为c(NH3)=
,溶于水形成的氨水的浓度为c(NH3)= ![]() ,故答案为:3mol/L;
,故答案为:3mol/L;
(4)1.505×1023个A气体分子的质量为31g,根据物质的量相等可列式![]() ,解得M(A)=124g/mol,故答案为:124g/mol。
,解得M(A)=124g/mol,故答案为:124g/mol。

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目