题目内容
 铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料.(1)铝元素在元素周期表中的位置是
第三周期第ⅢA族
第三周期第ⅢA族
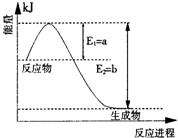
.(2)铝电池性能优越,铝-空气电池以其环保、安全而受到越来越多的关注,其原理如图所示.
①该电池的总反应化学方程式为
4Al+3O2+6H2O=4Al(OH)3
4Al+3O2+6H2O=4Al(OH)3
;②电池中的NaCl的作用为
增强溶液的导电能力
增强溶液的导电能力
;③以铝-空气电池为电源电解kl溶液制取KlO3(石墨为电极材料)时,电解过程中阳极的电极反应式为
I-+3H2O-6e-=IO3-+6H+
I-+3H2O-6e-=IO3-+6H+
;④某铝一空气电池的效率为50%,若用其作电源电解500ml的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3mol?L-1,则该过程中消耗铝的质量为
2.7g
2.7g
.(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理.
①氯化铝矿粉在加热条件下易升华,气态氯化铝的化学式Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为


②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式
Al2O3+3C+3Cl2
2AlCl3+3CO
| ||
Al2O3+3C+3Cl2
2AlCl3+3CO
.
| ||
分析:(1)根据铝的电子层数和最外层电子数确定其在周期表中的位置;
(2)①铝和氧气、水能反应生成氢氧化铝;
②溶液中自由移动的离子浓度越大,溶液的导电性越强;
③阳极上失电子发生氧化反应;
④先根据氢氧化钠的物质的量计算电解时转移电子的物质的量,再根据原电池中电池的效率计算原电池中转移电子的物质的量,最后根据转移电子的物质的量计算消耗的铝的质量;
(3)①根据氯化铝的结构特点结合题意写出结构式;
②根据反应物、生成物和反应条件写出反应方程式.
(2)①铝和氧气、水能反应生成氢氧化铝;
②溶液中自由移动的离子浓度越大,溶液的导电性越强;
③阳极上失电子发生氧化反应;
④先根据氢氧化钠的物质的量计算电解时转移电子的物质的量,再根据原电池中电池的效率计算原电池中转移电子的物质的量,最后根据转移电子的物质的量计算消耗的铝的质量;
(3)①根据氯化铝的结构特点结合题意写出结构式;
②根据反应物、生成物和反应条件写出反应方程式.
解答:解:(1)铝原子原子核外有3个电子层,最外层上有3个电子,所以其在周期表中的位置是第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)①铝和氧气、水能反应生成氢氧化铝,反应方程式为:4Al+3O2+6H2O=4Al(OH)3,故答案为:4Al+3O2+6H2O=4Al(OH)3;
②溶液中自由移动的离子浓度越大,溶液的导电性越强,水是弱电解质导电能力较小,为增大水的导电性,所以加入氯化钠,
故答案为:增强溶液的导电能力;
③阳极上失电子发生氧化反应,所以电解碘化钾溶液时,阳极上碘离子放电和水反应生成碘酸根离子和氢离子,电极反应式为:I-+3H2O-6e-=IO3-+6H+,
故答案为:I-+3H2O-6e-=IO3-+6H+;
④电解氯化钠溶液后,氢氧化钠的物质的量=0.3mol/L×0.5L=0.15mol,设电解过程中电子转移的物质的量是x,
2NaCl+2H2O
2NaOH+Cl2↑+H2↑ 转移电子
2mol 2mol
0.15mol x
x=0.15mol
某铝一空气电池的效率为50%,所以原电池中转移电子的物质的量是0.3mol,设消耗铝的质量为y.
Al-3e-=Al3+
27g 3mol
y 0.3mol
y=2.7g
故答案为:2.7g;
(3)①氯化铝为共价化合物,氯原子提供孤对对子,铝原子提供空轨道,形成配位键,使所有原子均达到8电子稳定结构,所以结构式为 ,故答案为:
,故答案为: ;
;
②根据题意知,反应物是氧化铝、碳和氯气,反应条件是加热,生成物是氯化铝和一氧化碳,所以其反应方程式为:Al2O3+3C+3Cl2
2AlCl3+3CO,
故答案为:Al2O3+3C+3Cl2
2AlCl3+3CO.
(2)①铝和氧气、水能反应生成氢氧化铝,反应方程式为:4Al+3O2+6H2O=4Al(OH)3,故答案为:4Al+3O2+6H2O=4Al(OH)3;
②溶液中自由移动的离子浓度越大,溶液的导电性越强,水是弱电解质导电能力较小,为增大水的导电性,所以加入氯化钠,
故答案为:增强溶液的导电能力;
③阳极上失电子发生氧化反应,所以电解碘化钾溶液时,阳极上碘离子放电和水反应生成碘酸根离子和氢离子,电极反应式为:I-+3H2O-6e-=IO3-+6H+,
故答案为:I-+3H2O-6e-=IO3-+6H+;
④电解氯化钠溶液后,氢氧化钠的物质的量=0.3mol/L×0.5L=0.15mol,设电解过程中电子转移的物质的量是x,
2NaCl+2H2O
| ||
2mol 2mol
0.15mol x
x=0.15mol
某铝一空气电池的效率为50%,所以原电池中转移电子的物质的量是0.3mol,设消耗铝的质量为y.
Al-3e-=Al3+
27g 3mol
y 0.3mol
y=2.7g
故答案为:2.7g;
(3)①氯化铝为共价化合物,氯原子提供孤对对子,铝原子提供空轨道,形成配位键,使所有原子均达到8电子稳定结构,所以结构式为
 ,故答案为:
,故答案为: ;
;②根据题意知,反应物是氧化铝、碳和氯气,反应条件是加热,生成物是氯化铝和一氧化碳,所以其反应方程式为:Al2O3+3C+3Cl2
| ||
故答案为:Al2O3+3C+3Cl2
| ||
点评:本题考查了结构式、电极反应式、化学反应方程式的书写、物质的量的有关计算等知识点,注意氯化铝结构式的书写,为易错点,该结构式中存在配位键导致容易写错.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目