题目内容
某溶液中加入铝粉有氢气产生,该溶液中一定能大量共存的离子组是 ( )
A.Na+、NO 、Cl-、SO 、Cl-、SO | B.Na+、K+、Ba2+、HCO |
| C.Fe2+、NH4+、NO3?、Cl- | D.Na+、K+、Cl-、SO |
D
解析试题分析:离子间如果发生化学变化,则不能大量共存,反之是可以的。某溶液中加入铝粉有氢气产生,说明该溶液可能显酸性,也可能显碱性。A中如果显酸性,则在酸性条件下NO3-和铝反应得不到氢气;B中HCO3-和H+或OH-都反应,得不到不能大量共存;C中如果显碱性,Fe2+、NH4+不能大量共存;如果显酸性,则在酸性条件下NO3-和Fe2+发生氧化还原反应,因此正确的答案选D。
考点:考查离子共存的正误判断
点评:该题是高考中的高频题,属于中等难度的试题,试题侧重考查学生的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。

 名校课堂系列答案
名校课堂系列答案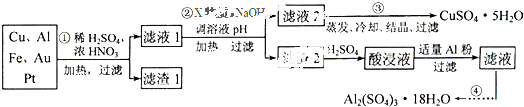
按要求回答下列问题:
(1)滤渣1中存在的金属有
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是
(4)用一个离子方程式表示在酸浸液中加入足量铝粉的反应:
(5)由CuSO4?5H2O制备CuSO4时,应把CuSO4?5H2O放在
(6)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是
A.Ksp(CuCO3)<Ksp(CaCO3) B.c(Cu2+)<c(Ca2+)
C.
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe2+ |
7.0 |
9.0 |
|
Fe3+ |
1.9 |
3.7 |
|
Cu2+ |
4.9 |
6.7 |
|
Al3+ |
3.0 |
4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是____________________。
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:___________________。
(5)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在______(填仪器名称)中加热脱水。
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
 研究金属的冶炼对人类有重要意义.
研究金属的冶炼对人类有重要意义. (3)右图是部分金属氧化物被一氧化碳还原时lg[p(CO)/p(CO2)]与温度的关系曲线图。则四种金属氧化物中最易被还原的金属氧化物是 ,该反应的△H 0。
(3)右图是部分金属氧化物被一氧化碳还原时lg[p(CO)/p(CO2)]与温度的关系曲线图。则四种金属氧化物中最易被还原的金属氧化物是 ,该反应的△H 0。