题目内容
已知实验室制氯气的化学方程式为:MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O,现用足量浓盐酸在加热条件下跟二氧化锰反应制取氯气.若标准状况下制得Cl22.24L求:
(1)二氧化锰的质量;
(2)把(1)中反应后的溶液稀释到50mL,从中取出10.0mL,加入10.0mL 0.600mol/L的硝酸银溶液,恰好将氯离子完全沉淀.求(1)中反应后溶液稀释到50mL时氯离子的物质的量浓度是多少?
(1)二氧化锰的质量;
(2)把(1)中反应后的溶液稀释到50mL,从中取出10.0mL,加入10.0mL 0.600mol/L的硝酸银溶液,恰好将氯离子完全沉淀.求(1)中反应后溶液稀释到50mL时氯离子的物质的量浓度是多少?
(1)n(Cl2)=
=0.1mol,
MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O
1 1
n(MnO2) 0.1mol
n(MnO2)=0.1mol,
m(MnO2)=0.1mol×87g/mol=8.7g,
答:二氧化锰的质量为8.7g;
(2)n(AgNO3)=0.01L×0.600mol/L=0.006mol,
由反应Ag++Cl-=AgCl↓可知:10.0ml溶液中:n(Cl-)=n(AgNO3)=0.006mol,
则50ml溶液中含有的Cl-物质的量为:0.006mol×5=0.03mol,
所以:(1)中反应后溶液稀释到50mL时氯离子的物质的量浓度是:c(Cl-)=
=0.6mol/L,
答::(1)中反应后溶液稀释到50mL时氯离子的物质的量浓度是0.6mol/L.
| 2.24L |
| 22.4L/mol |
MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O
1 1
n(MnO2) 0.1mol
n(MnO2)=0.1mol,
m(MnO2)=0.1mol×87g/mol=8.7g,
答:二氧化锰的质量为8.7g;
(2)n(AgNO3)=0.01L×0.600mol/L=0.006mol,
由反应Ag++Cl-=AgCl↓可知:10.0ml溶液中:n(Cl-)=n(AgNO3)=0.006mol,
则50ml溶液中含有的Cl-物质的量为:0.006mol×5=0.03mol,
所以:(1)中反应后溶液稀释到50mL时氯离子的物质的量浓度是:c(Cl-)=
| 0.03mol |
| 0.05L |
答::(1)中反应后溶液稀释到50mL时氯离子的物质的量浓度是0.6mol/L.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
 (4)可用下图实验装置精制粗溴。
(4)可用下图实验装置精制粗溴。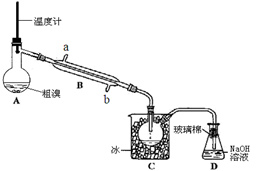
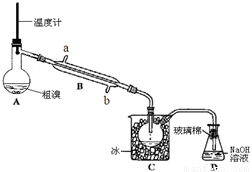
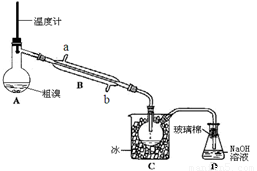
 ①反应过程中需要对A容器加热,加热的方法是
。
①反应过程中需要对A容器加热,加热的方法是
。