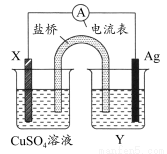
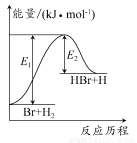
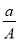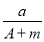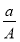题目内容
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示:
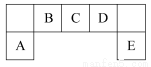
(1)B、C、D元素电负性的大小顺序为: > > (填元素符号)。
(2)E的氢化物与其最高价氧化物对应的水化物的钾盐共热能发生反应生成一种气体单质,反应的化学方程式为 。
(3)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L甲气体与0.5 L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是 。
(4)在298 K下,A、B的单质各1 mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来,若此置换反应生成3 mol B的单质,则该反应在298 K下的ΔH= 。(注:题中所设单质均为最稳定单质)
(5)要证明与D同主族相邻元素F的非金属性与E的非金属性的强弱,正确、合理的实验操作及现象是 。
(6)用A、B的单质作电极,C的最高价氧化物对应水化物的浓溶液作电解质溶液构成原电池,写出此原电池正极的电极反应式 。(假设C只被还原至+4价)
(1)O;N;C (2)8HCl+KClO4 KCl+4Cl2↑+4H2O (3)NaNO2 (4)-(4a-3b) kJ/mol或(3b-4a) kJ/mol (5)将氯水(或氯气)滴入(或通入)到硫化钠(或硫化氢等)溶液中,有淡黄色沉淀生成(答案合理即可) (6)NO3-+e-+2H+=NO2↑+H2O
KCl+4Cl2↑+4H2O (3)NaNO2 (4)-(4a-3b) kJ/mol或(3b-4a) kJ/mol (5)将氯水(或氯气)滴入(或通入)到硫化钠(或硫化氢等)溶液中,有淡黄色沉淀生成(答案合理即可) (6)NO3-+e-+2H+=NO2↑+H2O
【解析】由已知的元素周期表的结构可推知:A、B、C、D、E五种元素分别是Al、C、N、O、Cl。(1)电负性O>N>C。(2)生成的气体单质是Cl2,反应的化学方程式为:8HCl+KClO4 KCl+4Cl2↑+4H2O。(3)氮的氧化物中,NO的相对分子质量最小,2 L NO与0.5 L O2混合后先生成1 L NO与1 L NO2的混合气体,再与NaOH溶液发生下列反应:NO+NO2+2NaOH=2NaNO2+H2O,所以生成的盐是NaNO2(也可用电子守恒法推出N在盐中显+3价,所以是NaNO2)。(4)在298 K下,1 mol Al(s)完全燃烧放出热量a kJ,1 mol C(s)完全燃烧放出热量b kJ,根据盖斯定律可得,该反应在298 K下的ΔH为-(4a-3b) kJ·mol-1或(3b-4a) kJ·mol-1。(5)要证明S的非金属性与Cl的非金属性强弱,可以利用置换反应,将氯水(或氯气)滴入(或通入)硫化钠(或硫化氢等)溶液中即可(答案合理即可)。(6)常温下,Al被浓硝酸钝化,碳与浓硝酸反应生成CO2和NO2,故碳为原电池负极,正极上硝酸得电子生成NO2。
KCl+4Cl2↑+4H2O。(3)氮的氧化物中,NO的相对分子质量最小,2 L NO与0.5 L O2混合后先生成1 L NO与1 L NO2的混合气体,再与NaOH溶液发生下列反应:NO+NO2+2NaOH=2NaNO2+H2O,所以生成的盐是NaNO2(也可用电子守恒法推出N在盐中显+3价,所以是NaNO2)。(4)在298 K下,1 mol Al(s)完全燃烧放出热量a kJ,1 mol C(s)完全燃烧放出热量b kJ,根据盖斯定律可得,该反应在298 K下的ΔH为-(4a-3b) kJ·mol-1或(3b-4a) kJ·mol-1。(5)要证明S的非金属性与Cl的非金属性强弱,可以利用置换反应,将氯水(或氯气)滴入(或通入)硫化钠(或硫化氢等)溶液中即可(答案合理即可)。(6)常温下,Al被浓硝酸钝化,碳与浓硝酸反应生成CO2和NO2,故碳为原电池负极,正极上硝酸得电子生成NO2。

相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是( )
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
下表是元素周期表的一部分,有关说法正确的是( )
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 |
|
|
| c |
| d |
|
3 | a | b |
|
|
| e | f |
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强