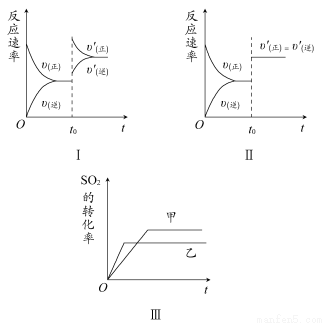
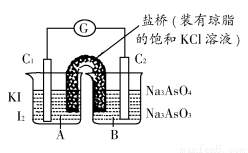
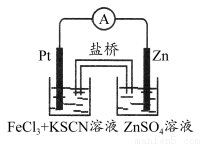
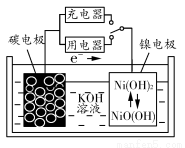
题目内容
根据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示,其中盐桥为琼胶?饱和KNO3盐桥。请回答下列问题。( )
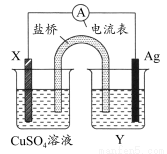
(1)电极X的材料是________,电解质溶液Y是________。
(2)银电极为电池的________极,写出两电极的电极反应式:
银电极:_________________________________________________;
X电极:___________________________________________________。
(3)外电路中,电子是从________电极流向________电极。
(1)铜(或Cu);AgNO3溶液 (2)正;Ag++e-=Ag;Cu-2e-=Cu2+ (3)Cu;Ag
【解析】该题考查原电池的基本原理,根据所给反应的设计要求并结合所给装置可看出:X极是Cu,电解质溶液Y为AgNO3溶液,因为Cu比Ag活泼,所以Cu为负极,Ag为正极,电极反应式分别为:负极:Cu-2e-=Cu2+,正极:Ag++e-=Ag,在外电路,电子由负极Cu流向正极Ag。

练习册系列答案
相关题目
室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合后的体积变化)( )
序号 | ① | ② | ③ | ④ |
pH | 12 | 12 | 2 | 2 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7