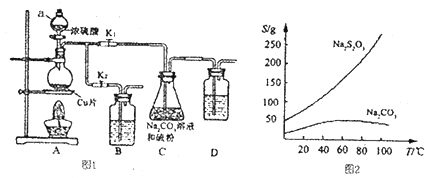
题目内容
【题目】配制一定体积、一定物质的量浓度的溶液,实验结果产生偏高影响的是( )
A.容量瓶中原有少量蒸馏水
B.溶解所用的烧杯未洗涤
C.称量时左码右物
D.定容时俯视观察液面
【答案】D
【解析】解:A.容量瓶中有少量的蒸馏水,不会影响溶质的物质的量及最终溶液体积,所以不影响配制结果,故A错误; B.溶解所用的烧杯没有洗涤,会导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故B错误;
C.称量是砝码和药品颠倒,会导致称量的药品质量偏小,配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故C错误;
D.定容时俯视观察液面,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液的物质的量浓度偏高,故D正确;
故选D.

 阅读快车系列答案
阅读快车系列答案【题目】CO2是引起“温室效应”的主要物质,CO2的甲烷化可以实现其循环利用。
甲烷化过程中,可能发生如下反应:
I. CO2 (g)+4H2(g) ![]() CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
II. CO2 (g)+4H2(g) ![]() CO(g)+2H2O(g) △H2
CO(g)+2H2O(g) △H2
已知反应II中相关的化学键键能数据如下:
化学键 | H—H | C=O | C | H—O |
E/(kJ·mol-1) | 436 | 750 | 1076 | 463 |
由此计算△H2=_________________。
(2)在常压、催化剂条件下,将CO2 和H2 (体积比为1:4,总物质的量为m mol)置于密闭容器中,发生反应I和II。测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)
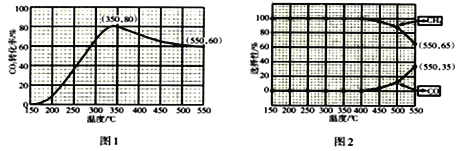
①由图1和图2可知,△H1___0(填“>”或“<”),____________可影响催化剂的选择性。
②由图1可知CO2的转化率呈现先升高后降低的变化趋势,其原因是________________________________。
③下列措施能提高CO2平衡转化率的是__________(填标号)
A.提高原料气中H2所占比例 B.适当增大压强 C.升高温度 D.增大催化剂的比表面积 E.前段加热,后段冷却
④350℃时,反应在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为_____(用m、V表示)。
⑤550℃时,反应在t2时刻达到平衡,此时容器中H2O(g)的物质的量为__mol(用m表示)
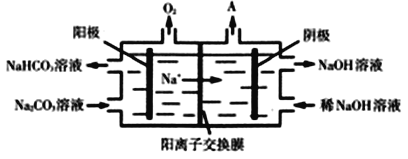
(3)CO2与NaOH溶液反应得到Na2CO3溶液。电解Na2CO3溶液的原理如图所示,阳极的电极反应式为______________________________________。
【题目】元素是构成我们生活的世界中一切物质的“原材料”。
Ⅰ.1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
Ni=Co=59 | |||||
H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
C=12 | Si=28 | ?=70 | Sn=118 | ||
N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
O=16 | S=32 | Se=79.4 | Te=128? | ||
F=19 | Cl=35.5 | Br=80 | I=127 | ||
Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
Ca=40 | Pb=207 |
(1)门捷列夫将已有元素按照相对原子质量排序,同一_____(填“横行”或“纵列”)元素性质相似。
(2)结合表中信息,猜想第5列方框中“Te=128?”的问号表达的含义是___________。
Ⅱ.X、Y、Z、W是现在元素周期表中的短周期元素,它们的相对位置如下图所示,其中 Y 元素原子核外最外层电子数是其电子层数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中的位置____________________。
(2)比较Y、Z气态氢化物的稳定性______________(用分子式表示)。
(3)科学家们认为存在含氢量最高的化合物XH5,预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___________,XH5是离子化合物,它的电子式为________。
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式_______________________________。
【题目】下列物质的分类正确的是
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | NaOH | H2SO4 | BaCO3 | SO2 | CO2 |
B | Ba(OH)2 | HCl | NaCl | Na2O | CO |
C | NaOH | CH3COOH | CaCl2 | CO | SO2 |
D | KOH | HClO | CaCO3 | CaO | SO3 |
A.AB.BC.CD.D
【题目】除去下列括号内的杂质,所加试剂和操作均正确的是( )
选项 | 需除杂的物质 | 试剂 | 操作 |
A | NaCl(Na2CO3) | 稀盐酸 | 蒸发结晶 |
B | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
C | Cl2(H2O) | 碱石灰 | 洗气 |
D | CO2(CO) | ﹣﹣ | 点燃 |
A.A
B.B
C.C
D.D