题目内容
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-(溴离子)、SO42-、Na+、Mg2+、Ca2+等,都是重要资源。
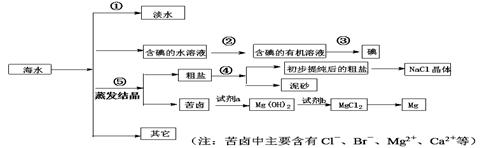
(1)写出步骤①、②、④分离提纯的方法:
① ② ④
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称 。
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、 溶液、 溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应 。向所得溶液中滴加 至无气泡产生,再经蒸发结晶得到食盐晶体。
(4)检验淡水中是否含有Cl-的操作现象及结论 。
(5)写出加入试剂a后,发生反应的离子方程式 、
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和消石灰制取漂白粉的化学方程式 。
18.
(1)① 蒸馏 ② 萃取分液 ④ 过滤 (2)② 分液漏斗、烧杯 。
(3) BaCl2、 Na2CO3 ,稍过量 。 稀盐酸 (其它1分) 。
(4) 取样,先滴加几滴稀硝酸,再滴加硝酸银,若产生白色沉淀则有Cl—(2分)。
(5)Mg2++OH-=Mg(OH)2
(2分)、(6)2 Cl2+2 Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O(2分)。
【解析】
试题分析:(1)①是直接从海水转化为淡水,故为蒸馏,②是由含碘的水溶液转化为含碘的有机溶液,溶剂的种类变了,故可以通过萃取分液,④是由粗盐转化为初步提纯的粗盐和沉淀,说明是过滤。
(2)步骤②分离提纯是萃取分液,故需要用到的主要玻璃仪器为分液漏斗和烧杯
(3)粗盐的提取,要注意是先除去SO42-,然后再除去Ca2+和Ba2+,且每次都要加过量,最后除去CO32-
(4)检验Cl-的操作方法为取样,先滴加几滴稀硝酸,再滴加硝酸银,若产生白色沉淀则有Cl—
(5)苦卤中加入试剂a后,生成了Mg(OH)2,而苦卤中含有镁离子,所以离子方程式为
Mg2++OH-=Mg(OH)2
(6)消石灰为氢氧化钙,故方程式为2 Cl2+2 Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O
考点:海水的利用
点评:此题通过对海水的利用这一知识点展开对食盐提纯相关的步骤考核和对添加除杂试剂先后顺序的认识,终合性比较强。

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案


