题目内容
铝是用途广泛的金属(1)对金属制品进行抗腐蚀处理,可延长其使用寿命.以下为铝材表面处理的一种方法:
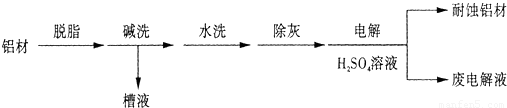
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是(用离子方程式表示)______.为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的______.
A.NH3 B.CO2 C.NaOH D.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为______
______.取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的离子方程式是______
(2)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
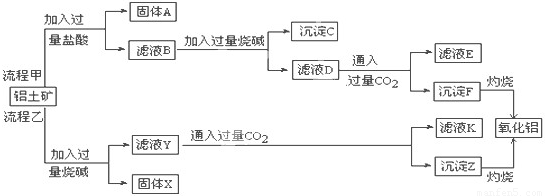
①流程甲加入盐酸后生成Al3+的离子方程式为______.
②滤液E、K中溶质的主要成份是______ (填化学式),写出该溶液的一种用途______.
【答案】分析:(1)①有气泡冒出因2Al+2OH-+2H2O═2AlO2-+3H2↑;因碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
(2)①根据Al2O3与盐酸反应生成氯化铝和水,书写离子方程式;
②根据工艺流程甲可知,固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠.
解答:解:(1)①铝能与强碱反应产生氢气,Al(OH)3具有两性,既能与强碱反应也能与强酸反应生成盐和水,碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解,
故答案为:2Al+2OH-+2H2O═2AlO+3H2↑;b;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解.3HCO3-+Al3+=3CO2↑+Al(OH)3↓;或HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀,
故答案为:2Al+3H2O-6e-═Al2O3+6H+;3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
(2)Al2O3与盐酸反应生成氯化铝和水,离子方程式为Al2O3+6H+═2Al3++3H2O,
故答案为:Al2O3+6H+═2Al3++3H2O;
(3)根据工艺流程甲可知,固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,滤液Y是铝土矿溶解在氢氧化钠溶液中,生成偏铝酸钠和硅酸钠,通入过量二氧化碳生成碳酸氢钠和硅酸沉淀,滤液K为碳酸氢钠溶液;碳酸氢钠可用于制纯碱或做发酵粉等,
故答案为:NaHCO3;制纯碱或做发酵粉等.
点评:本题以流程图来呈现实验过程的探究性考题,是近几年中考探究题命题特点之一.读懂实验流程图,明确实验步骤和原理,是正确解答此类问题的前提.
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
(2)①根据Al2O3与盐酸反应生成氯化铝和水,书写离子方程式;
②根据工艺流程甲可知,固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠.
解答:解:(1)①铝能与强碱反应产生氢气,Al(OH)3具有两性,既能与强碱反应也能与强酸反应生成盐和水,碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解,
故答案为:2Al+2OH-+2H2O═2AlO+3H2↑;b;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解.3HCO3-+Al3+=3CO2↑+Al(OH)3↓;或HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀,
故答案为:2Al+3H2O-6e-═Al2O3+6H+;3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
(2)Al2O3与盐酸反应生成氯化铝和水,离子方程式为Al2O3+6H+═2Al3++3H2O,
故答案为:Al2O3+6H+═2Al3++3H2O;
(3)根据工艺流程甲可知,固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,滤液Y是铝土矿溶解在氢氧化钠溶液中,生成偏铝酸钠和硅酸钠,通入过量二氧化碳生成碳酸氢钠和硅酸沉淀,滤液K为碳酸氢钠溶液;碳酸氢钠可用于制纯碱或做发酵粉等,
故答案为:NaHCO3;制纯碱或做发酵粉等.
点评:本题以流程图来呈现实验过程的探究性考题,是近几年中考探究题命题特点之一.读懂实验流程图,明确实验步骤和原理,是正确解答此类问题的前提.

练习册系列答案
相关题目
合金是一类用途广泛的金属材料.下列物质中,不属于合金的是( )
| A、碳素钢 | B、黄铜 | C、硬铝 | D、水银 |


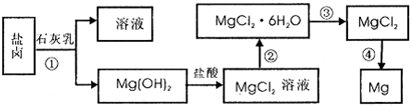
 等)中模拟工业生产来提取镁,主要过程如下,回答下列问题:
等)中模拟工业生产来提取镁,主要过程如下,回答下列问题: