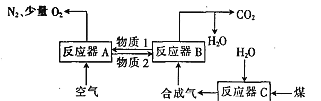
题目内容
【题目】利用下图装置(夹持装置略)制取和收集纯净、干燥的氨气,并探究氨气的性质。
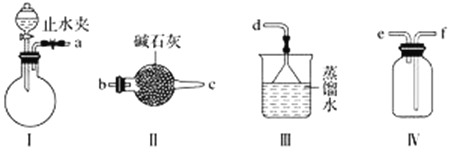
(1)关闭装置Ⅰ中的止水夹,向分液漏斗中加适量水,打开活塞,说明Ⅰ气密性良好的现象是______________________。
(2)利用装置Ⅰ制取氨气,不能选用的试剂为浓氨水和________(填字母)。
A.氢氧化钠 B.碱石灰 C.硝酸钾 D.生石灰
(3)根据实验要求,仪器连接的顺序(用字母编号表示):a接________、________接________、______接______。______
(4)收集氨气,按如图装置进行NH3性质的探究实验。
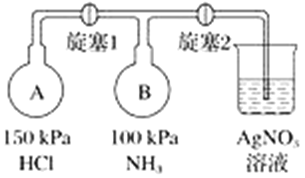
①打开旋塞1,B瓶中的现象是_________________________________________,原因是_____________________________________________,稳定后,关闭旋塞1;
②再打开旋塞2,B瓶中的现象是__________________________________________。
【答案】分液漏斗内液面不再下降 C c b e f d 产生白色的烟 氯化氢与氨气反应生成了氯化铵小颗粒,NH3+HCl=NH4Cl,氯化铵小颗粒形成白烟 烧杯中的硝酸银溶液会倒流进入到B瓶中,B瓶中生成白色沉淀(提示:A中气体压强大于B中)
【解析】
(1)利用注水法检验装置的气密性;
(2)利用装置I制取氨气,为常温下固液制取气体的装置,据此分析;
(3)依据氨气的物质性质和化学性质选择连接方式;
(4)A中压强大,HCl进入B中,与氨气反应生成氯化铵固体;关闭旋塞①,再打开旋塞②,烧杯中的AgNO3溶液会倒流进入到B瓶中,反应生成AgCl。
(1)关闭A装置中的止水夹,向分液漏斗中加入适量水,打开活塞,分液漏斗内液面高度保持不变(或液体不再滴下),说明A装置气密性良好,故答案为:分液漏斗内液面不再下降;
(2)利用装置I制取氨气,为常温下固液制取气体的装置,可为浓氨水与CaO、氢氧化钠,CaO+H2O=Ca(OH)2、消耗水并放热,根据NH3+H2O![]() NH3
NH3![]() H2O
H2O![]() NH4++OH-可知,氢氧化钙、氢氧化钠溶于水电离出氢氧根离子,氢氧根离子浓度增大平衡逆向移动,使氨气逸出,且温度升高,降低氨气的溶解度,使氨气逸出,A、B、D符合条件,硝酸钾溶于水没有明显的热效应,不能与浓氨水制备氨气,故答案为:C;
NH4++OH-可知,氢氧化钙、氢氧化钠溶于水电离出氢氧根离子,氢氧根离子浓度增大平衡逆向移动,使氨气逸出,且温度升高,降低氨气的溶解度,使氨气逸出,A、B、D符合条件,硝酸钾溶于水没有明显的热效应,不能与浓氨水制备氨气,故答案为:C;
(3)利用装置I制取氨气,制出的氨气中含有水蒸气,需进行干燥,选用装置Ⅱ,粗口进,细口出,所以a连接cb;根据氨气的密度小于空气的密度,应为向下排气法收集,所以选择收集装置应为“短进长出”,所以再连接ef,氨气属于极易溶于水,还是大气污染气体,用防倒吸的装置进行尾气吸收连接d,所以连接顺序为cbefd,故答案为:c;b;e;f;d;
(4)A容器压强为150 kPa,B容器压强100 kPa,A容器压强大于B容器,先打开旋塞①,A容器中的氯化氢进入B容器,氨气和氯化氢反应,NH3+HCl=NH4Cl,生成氯化铵固体小颗粒,所以B瓶中的现象是出现白烟,氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,再打开旋塞②,硝酸银倒吸入B瓶中,氯化铵与硝酸银反应生成白色的氯化银沉淀。故答案为:产生白色的烟;氯化氢与氨气反应生成了氯化铵小颗粒,NH3+HCl=NH4Cl,氯化铵小颗粒形成白烟;烧杯中的硝酸银溶液会倒流进入到B瓶中,B瓶中生成白色沉淀(提示:A中气体压强大于B中)。

【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素