题目内容
有A、B、C、D、E五种短周期元素,其原子序数依次增大.A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能分别为:578、1817、2745、11575.请回答下列问题:(1)C、D两元素形成的化合物的晶体类型是______.BC2的结构式______;
(2)若F是D的同主族下一周期元素,则F的电子排布式是:______,
(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式______.
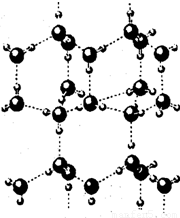
(4)A2C分子间因存在“氢键”的作用而彼此结合形成(A2C)n.在该分子形成的晶体中每个A2C分子被4个A2C分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如图所示,试填空.
①含1molA2C的该晶体中有______mol“氢键”.
②若G是C的同主族下一周期元素,请比较A2C与 A2G 沸点的高低______.
【答案】分析:有A、B、C、D、E五种短周期元素,其原子序数依次增大.
A原子的电子层数与它的核外电子总数相同,则A为氢元素;
B原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,K层容纳2个电子,所以B为碳元素;
C元素的原子基态时2p能级是2s能级上的电子数的2倍,则L层有6个电子,所以C为氧元素;
D是所在周期中原子半径最大的主族元素,D原子序数>氧元素,则D为Na元素;
E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575,第四电离能剧增,则E易形成+3离子,则E为Al元素.
解答:解:有A、B、C、D、E五种短周期元素,其原子序数依次增大.A原子的电子层数与它的核外电子总数相同,则A为氢元素;B原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,K层容纳2个电子,所以B为碳元素;C元素的原子基态时2p能级是2s能级上的电子数的2倍,则L层有6个电子,所以C为氧元素;D是所在周期中原子半径最大的主族元素,D原子序数>氧元素,则D为Na元素;E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575,第四电离能剧增,则E易形成+3离子,则E为Al元素.
即A为氢元素;B为碳元素;C为氧元素;D为Na元素;E为Al元素.
(1)C为氧元素;D为Na元素,两元素形成的化合物为氧化钠、过氧化钠,二者属于离子化合物;
B为碳元素;C为氧元素,BC2为CO2,是共价化合物,碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O.
故答案为:离子晶体;O=C=O.
(2)D为Na元素,若F是D的同主族下一周期元素,则F为K元素,质子数为19,电子排布式是:1S22S22P63S23P64S1.
故答案为:1S22S22P63S23P64S1.
(3)E的最高价氧化物对应的水化物为Al(OH)3,D的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠和水,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
(4)①该分子形成的晶体中每个A2C分子通过氢键与4个A2C分子理解,每个氢键为A2C分子提供 ,所以含1molA2C的该晶体中有 1mol×4×
,所以含1molA2C的该晶体中有 1mol×4× =2mol“氢键”.
=2mol“氢键”.
故答案为:2.
②C为氧元素,G是C的同主族下一周期元素,则G为S元素,所以A2C为H2O,A2G为H2S,H2O中存在氢键,常温下为液体,所以沸点H2O>H2S.
故答案为:H2O>H2S.
点评:以元素推断为载体,考查原子的结构性质与位置关系、核外电子排布、晶体结构、化学用语等,难度中等,是对所学知识的综合考查,注意基础知识的掌握.
A原子的电子层数与它的核外电子总数相同,则A为氢元素;
B原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,K层容纳2个电子,所以B为碳元素;
C元素的原子基态时2p能级是2s能级上的电子数的2倍,则L层有6个电子,所以C为氧元素;
D是所在周期中原子半径最大的主族元素,D原子序数>氧元素,则D为Na元素;
E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575,第四电离能剧增,则E易形成+3离子,则E为Al元素.
解答:解:有A、B、C、D、E五种短周期元素,其原子序数依次增大.A原子的电子层数与它的核外电子总数相同,则A为氢元素;B原子核外最外层电子数是次外层电子数的2倍,则B有2个电子层,K层容纳2个电子,所以B为碳元素;C元素的原子基态时2p能级是2s能级上的电子数的2倍,则L层有6个电子,所以C为氧元素;D是所在周期中原子半径最大的主族元素,D原子序数>氧元素,则D为Na元素;E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575,第四电离能剧增,则E易形成+3离子,则E为Al元素.
即A为氢元素;B为碳元素;C为氧元素;D为Na元素;E为Al元素.
(1)C为氧元素;D为Na元素,两元素形成的化合物为氧化钠、过氧化钠,二者属于离子化合物;
B为碳元素;C为氧元素,BC2为CO2,是共价化合物,碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O.
故答案为:离子晶体;O=C=O.
(2)D为Na元素,若F是D的同主族下一周期元素,则F为K元素,质子数为19,电子排布式是:1S22S22P63S23P64S1.
故答案为:1S22S22P63S23P64S1.
(3)E的最高价氧化物对应的水化物为Al(OH)3,D的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠和水,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
(4)①该分子形成的晶体中每个A2C分子通过氢键与4个A2C分子理解,每个氢键为A2C分子提供
 ,所以含1molA2C的该晶体中有 1mol×4×
,所以含1molA2C的该晶体中有 1mol×4× =2mol“氢键”.
=2mol“氢键”.故答案为:2.
②C为氧元素,G是C的同主族下一周期元素,则G为S元素,所以A2C为H2O,A2G为H2S,H2O中存在氢键,常温下为液体,所以沸点H2O>H2S.
故答案为:H2O>H2S.
点评:以元素推断为载体,考查原子的结构性质与位置关系、核外电子排布、晶体结构、化学用语等,难度中等,是对所学知识的综合考查,注意基础知识的掌握.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目