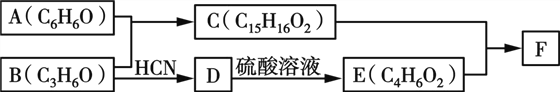
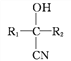
题目内容
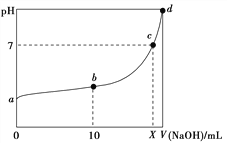
【题目】常温下,HNO2的电离平衡常数为K=4.6×10-4(已知![]() =2.14),向20 mL 0.01 mol·L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
=2.14),向20 mL 0.01 mol·L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
A. HNO2的电离方程式为HNO2===NO![]() +H+
+H+
B. a点H2O电离出的c(H+)=2.14×10-3 mol·L-1
C. b点溶液中离子浓度大小关系为c(NO![]() )>c(Na+)>c(H+)>c(OH-)
)>c(Na+)>c(H+)>c(OH-)
D. X值等于20
【答案】C
【解析】A.HNO2的电离平衡常数为K=4.6×10-4,亚硝酸为弱酸存在电离平衡,电离方程式为HNO2NO2-+H+,故A错误;B.由HNO2H++NO2-,K=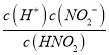 ≈
≈ ,4.6×10-4≈
,4.6×10-4≈![]() ,得到c(H+)=2.14×10-3mol/L,水电离出氢离子浓度远小于酸电离出氢离子,故B错误;C.b点溶液为HNO2、NaNO2混合溶液,且浓度比为1:1;由NO2-+H2OHNO2+OH-,HNO2H++NO2-,电离程度大于水解程度,可知溶液呈酸性,离子浓度大小为c(NO2-)>c(Na+)>c(H+)>c(OH-),故C正确;D.向20mL0.01molL-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,若恰好反应需要氢氧化钠溶液体积20ml,C点是溶液呈中性,溶质为HNO2、NaNO2混合溶液,X<20mL,故D错误;故选C。
,得到c(H+)=2.14×10-3mol/L,水电离出氢离子浓度远小于酸电离出氢离子,故B错误;C.b点溶液为HNO2、NaNO2混合溶液,且浓度比为1:1;由NO2-+H2OHNO2+OH-,HNO2H++NO2-,电离程度大于水解程度,可知溶液呈酸性,离子浓度大小为c(NO2-)>c(Na+)>c(H+)>c(OH-),故C正确;D.向20mL0.01molL-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,若恰好反应需要氢氧化钠溶液体积20ml,C点是溶液呈中性,溶质为HNO2、NaNO2混合溶液,X<20mL,故D错误;故选C。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目