题目内容
下列叙述正确的是
| A.标准状况下,l mol任何物质的体积均为22.4 L |
| B.CH4的摩尔质量为16 g |
| C.1mol H2O的质量为18 g?mol-1 |
| D.3.01×l023个SO2分子的质量为32 g |
D
试题分析:A、标准状况下,l mol任何气体的体积均为22.4 L,错误;B、摩尔质量的单位是g?mol-1 ,CH4的摩尔质量应为16 g?mol-1,错误;C、1mol H2O的质量应为18 g,错误;D、3.01×l023个SO2分子的物质的量为0.5mol,质量为32 g,正确。

练习册系列答案
相关题目
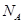 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是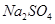 的溶液中含
的溶液中含
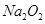 固体中含2
固体中含2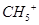 离子所含电子数为10
离子所含电子数为10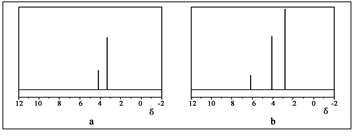
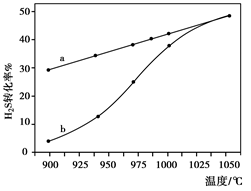
 H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。