题目内容
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 3B(g) 2C(g) ΔH=-192kJ·mol-1。向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y
B.若x∶y=1∶2,则平衡时,M中的转化率:A>B
C.若x∶y=1∶3,当M中放出热量172.8 kJ时,A的转化率为90%
D.若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时,v(正)<v(逆)
AD
解析:M容器保持恒容,N容器保持恒压,
由于反应前后的气体系数和不等,所以两个平衡态也不一样。要让M、N中平衡时A的体积分数一样,那么只能是M或N中,反应前后不论限度多少,A的体积分数始终为定值。
A(g) + 3B(g) 2C(g)
起始: x y
反应: z 3z 2z
平衡: x-z y-3z 2z
,则x=y,故A正确;
x∶y=1∶2,即y=2 x,设反应中消耗掉amol A
A(g) + 3B(g) 2C(g)
n(初始) x 2x 0
△n a 3a 2a
n(平衡)x-a 2x-3a 2a
A的转化率=a/x,B的转化率=3a/2x,则平衡时,M中的转化率:A<B,故B错误;
C、题目中热化学方程式的意义:若1mol A完全反应,放热192 kJ,
选项中:x∶y=1∶3,设反应中消耗掉bmol A
即y=3x,A(g)+ 3B(g) 2C(g) 放热
n(初始) x 3x 0 192x kJ
△n b 3b 2b 172.8 kJ
即 xmol:192x kJ= b:172.8 kJ,则b=0.9 mol
故A的转化率= b/ x=0.9/x,C错误;
D、 A(g) + 3B(g) 2C(g)
n(初始) 1.2 1 0
△n 0.2 0.6 0.4
n(平衡) 1 0.4 0.4
则平衡常数K=(0.2 mol/L)2/[0.5 mol/L×(0.2mol/L)3]=10
原平衡体系中,2.0L容器中含有分子1.0+0.4+0.4=1.8mol,当加入A,体系瞬间有分子1.8+0.36=2.16mol。N容器恒温、恒压,则容器体积比=气体的物质的量比,
即:2.16/1.8=V/2,瞬间总体积(V)变为2.16×2.00/1.8=2.4L,所以:
Q=(0.4 mol/2.4L)2/[(1.36 mol/2.4L) ×(0.4 mol/2.4L)3]=10.6
Q>K,所以,平衡要逆向移动,即v(正)<v(逆),故D正确;

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案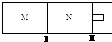 如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g)△H=-192kJ?mol-1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g)△H=-192kJ?mol-1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A、若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) | B、若x>3,达到平衡后B的转化率关系为:α(M)>α(N) | C、若x<3,C的平衡浓度关系为:c(M)>c(N) | D、x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等 |
 (2012?南通模拟)如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ?mol-1.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
(2012?南通模拟)如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)?2C(g)△H=-192kJ?mol-1.向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( ) 2C(g)
2C(g)
 xC(g)
xC(g)