题目内容
下列离子方程式书写正确的是
①等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混合
Ba2+ + 2OH – + NH4+ + HCO3 – = BaCO3↓+ NH3·H2O + H2O
②氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O = 4NH4+ + AlO2 – + 2H2O
③把Fe(OH)2固体投入到稀HNO3中:Fe(OH)2+2H+=Fe2++2H2O
④硫酸铝铵[NH4Al(SO4)2]溶液中滴加Ba(OH)2溶液并加热,刚好使NH4+全部转化为NH3:NH4++Al3++2SO42-+2Ba2++4OH- NH3↑+Al(OH)3↓+2BaSO4↓+H2O
NH3↑+Al(OH)3↓+2BaSO4↓+H2O
⑤过氧化钠固体与水反应:2O22?+2H2O=4OH?+O2↑
⑥氨水中通入过量二氧化硫:2NH3?H2O + SO2 = 2NH4+ +SO32? +H2O
| A.①③ | B.①④ | C.①⑥ | D.②④⑤ |
B
解析试题分析:①书写符合离子方程式的要求,正确。②氨水中的一水合氨是弱电解质,不能溶解氢氧化铝。反应的离子方程式为:Al3+ + 3NH3·H2O = 3NH4+ + Al(OH)3↓.错误。③HNO3除了有酸性,还有强的氧化性。所以把Fe(OH)2固体投入到稀HNO3中反应的离子方程式为:3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O.错误。④书写符合离子方程式的要求,正确。⑤离子方程式为:2Na2O2+2H2O=4Na++4OH?+O2↑。错误。⑥氨水中通入过量二氧化硫的离子方程式为: NH3?H2O + SO2 = NH4+ +HSO3? 。错误。
考点:考查离子方程式书写的知识。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案在无色的强碱性溶液中,能大量共存的是
| A.Na+、Al3+、NO3-、Cl- | B.K+、Na+、Cl-、AlO2- |
| C.Fe2+、K+、SO42-、Cl- | D.Na+、HCO3-、K+、NO3- |
水溶液中能大量共存的一组离子是:
| A.K+、Al3+、NO3-、CO32- | B.H+、Na+、Fe2+、NO3- |
| C.Na+、Ba2+、Cl-、NO3- | D.K+、NH4+、SO42-、OH- |
关于溶液的下列说法正确的是( )
| A.c(H+)︰c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 |
| B.水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 |
C.往0.1mol/LCH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中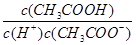 增大 增大 |
| D.等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 |
下列离子方程式,正确的是
| A.等物质的量的SO2与氢氧化钠溶液反应:SO2+OH-=HSO3- |
| B.用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2+H2O |
| C.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O=2HClO+CO32- |
D.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2+4H+ 2Cu+O2+4H+ |
能在水溶液中大量共存的一组离子是
A.H+、I-、NO 、SiO32- 、SiO32- | B.NH4+、OH-、Cl-、HCO |
C.K+、SO42-、Cu2+、NO | D.Al3+、Mg2+、SO 、CO 、CO |
下列反应的离子方程式书写不正确的是( )
| A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++ SO42- + NH4+= BaSO4↓+ NH3?H2O+H2O |
| B.氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3·H2O |
C.硫化钠的水解:S2-+ 2H2O H2S + 2OH- H2S + 2OH- |
| D.NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-= CaCO3↓+2H2O+ CO32- |
下列反应的离子方程式不正确的是
| A.NaOH溶液与稀H2SO4反应:H++OH—=H2O |
| B.NaHCO3与NaOH两溶液反应:HCO3-+OH—=CO32-+H2O |
| C.金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| D.AlCl3溶液中滴加过量的氨水:Al3++4OH-=AlO2-+2H2O |
下列各组离子一定能大量共存的是( )
| A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| B.在强碱性溶液中:Na+、K+、AlO2-、CO32- |
| C.在c(H+)=10-13 mol/L的溶液中:NH4+、Al3+、SO42-、NO3- |
| D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |