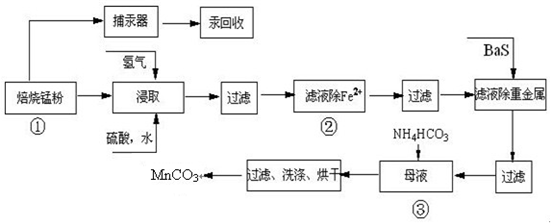
题目内容
碳酸锰
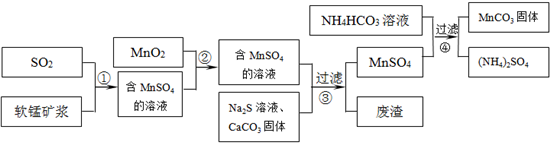
(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO3的生产流程如下图所示.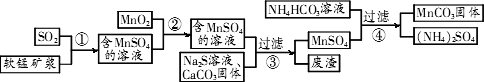
已知生成氢氧化物的
pH和有关硫化物的Ksp如下表: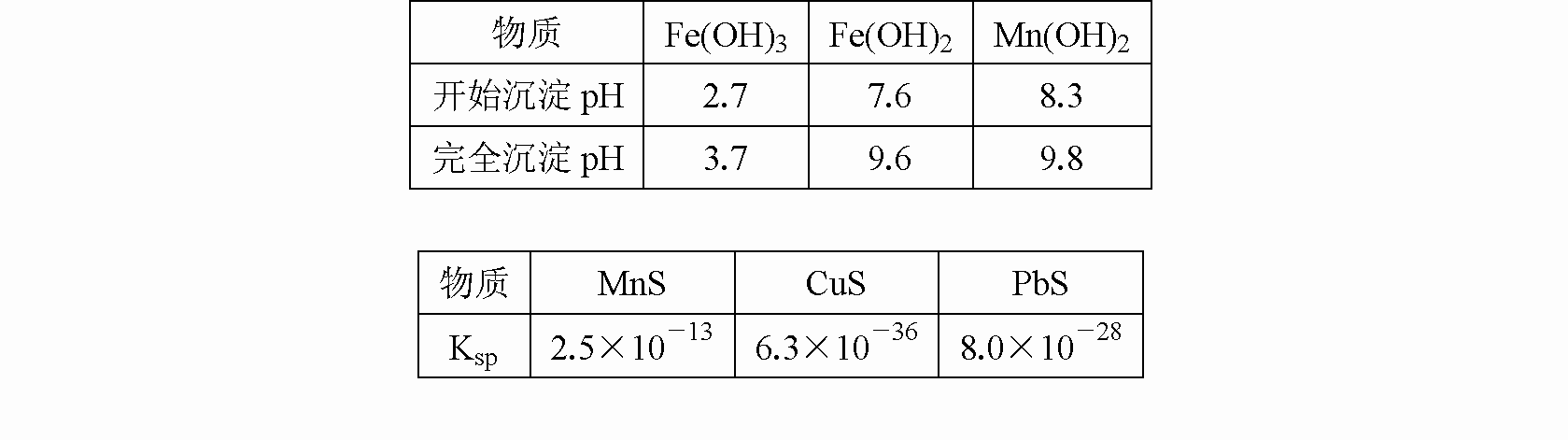
软锰矿主要成分为
MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气.流程①中主要发生的反应有:MnO2+SO2(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH________(填“大”或“小”),该流程可与________(填工业生产名称)联合,生产效益更高.
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为________
________,这样设计的目的和原理是________.
(3)反应②所得的含有MnSO4溶液中,c(Mn2+)=10-6 mol/L,c(Cu2+)=10-10 mol/L,c(Pb2+)=10-10 mol/L,在反应③中加入的Na2S溶液的物质的量浓度的取值范围为________,反应③中碳酸钙的作用是________.
(4)反应④发生的化学反应为:MnSO4+2NH4HCO3![]() MnCO3↓+(NH4)2SO4+CO2↑+H2O.反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是________,溶液的pH不能过低的原因是________.
MnCO3↓+(NH4)2SO4+CO2↑+H2O.反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是________,溶液的pH不能过低的原因是________.
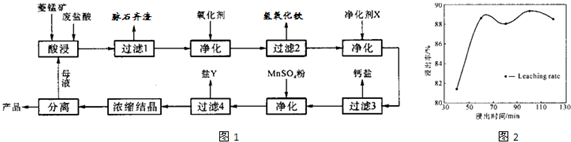
(5)软锰矿中锰的浸出有两种工艺:
工艺
答案:
解析:
 Mn2++2Fe3++2H2O 目的是使Fe2+转变为Fe3+,原理是Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)
Mn2++2Fe3++2H2O 目的是使Fe2+转变为Fe3+,原理是Fe3+完全沉淀的pH较低(或Fe3+更易沉淀)
 Mn2++2Fe3++2H2O.根据表中提供的信息,Fe2+、Mn2+与OH-反应生成Fe(OH)2、Mn(OH)2沉淀时,溶液的pH相差不大,不利于Mn2+的分离,但将Fe2+氧化为Fe3+时,生成Fe(OH)3沉淀与生成Mn(OH)2沉淀,二者溶液的pH相差大,有利于Mn2+的分离,将溶液的pH调控到3.7,Fe3+已经完全转化为Fe(OH)3沉淀,然后过滤即实现MnSO4与Fe(OH)3分离.
Mn2++2Fe3++2H2O.根据表中提供的信息,Fe2+、Mn2+与OH-反应生成Fe(OH)2、Mn(OH)2沉淀时,溶液的pH相差不大,不利于Mn2+的分离,但将Fe2+氧化为Fe3+时,生成Fe(OH)3沉淀与生成Mn(OH)2沉淀,二者溶液的pH相差大,有利于Mn2+的分离,将溶液的pH调控到3.7,Fe3+已经完全转化为Fe(OH)3沉淀,然后过滤即实现MnSO4与Fe(OH)3分离.
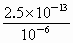 =2.5×10-7 mol/L.同理可计算出当溶液中Pb2+沉淀时,c(Na2S)=8.0×10-18 mol/L,此时溶液中的Cu2+已经沉淀完全,故8.0×10-10 mol/L<c(Na2S)<2.5×10-7 mol/L.含有MnSO4的溶液是酸性溶液,在酸性溶液中,Fe3+、Al3+不能与Mn2+分离,加入CaCO3固体,CaCO3与酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀而与Mn2+分离.
=2.5×10-7 mol/L.同理可计算出当溶液中Pb2+沉淀时,c(Na2S)=8.0×10-18 mol/L,此时溶液中的Cu2+已经沉淀完全,故8.0×10-10 mol/L<c(Na2S)<2.5×10-7 mol/L.含有MnSO4的溶液是酸性溶液,在酸性溶液中,Fe3+、Al3+不能与Mn2+分离,加入CaCO3固体,CaCO3与酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀而与Mn2+分离.
解析:
答案:
(1)小 工业制备硫酸(2)MnO2+2Fe2++4H+
(3)8.0×10-10 mol/L<c(Na2S)<2.5×10-7 mol/L 与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀
(4)使MnCO3沉淀完全 MnCO3沉淀量少,NH4HCO3与酸反应(或MnCO3、NH4HCO3与酸反应溶解)
(5)节约能源、治理含SO2的工业废气等
讲析:
(1)根据流程①中主要发生的反应可知,在形成的MnSO4溶液中含有H2SO4,所以所得的MnSO4溶液的pH比软锰矿浆的pH小.SO2主要来源于工业废气,而硫酸工业中产生的SO2废气最多、最集中,所以与工业制备硫酸相联合,能变废为宝,生产效益更高.(2)在酸性环境中,MnO2具有强氧化性,能将Fe2+氧化为Fe3+,自身被还原为Mn2+,同时生成H2O,其反应的离子方程式为:MnO2+2Fe2++4H+
(3)根据几种硫化物的Ksp值,加入一定浓度的Na2S时,能将溶液中Cu2+、Pb2+沉淀,而Mn2+不沉淀,根据MnS的Ksp=c(Mn2+)·c(S2-),当Mn2+生成沉淀时,c(Na2S)=c(S2-)=
(4)加入稍过量的NH4HCO3有利于MnSO4完全转化为MnCO3沉淀,因MnCO3能与H+反应导致MnCO3沉淀减少,降低了产率,同时NH4HCO3也能与H+反应,不利于MnSO4沉淀,且浪费试剂.
(5)根据A、B工业特点即可分析出工艺A的优点.
点评:本题以化学实验基础知识为平台,通过题述信息来考查学生的阅读能力和材料分析能力,体现了学以致用的高考命题思想.本题易错点一是阅读不仔细,如忽视溶液
pH与Ksp的关系,导致分析判断错误;二是分析A与B工业的优劣时,不能通过对比分析,从原料利用、环保等方面入手.
练习册系列答案
相关题目
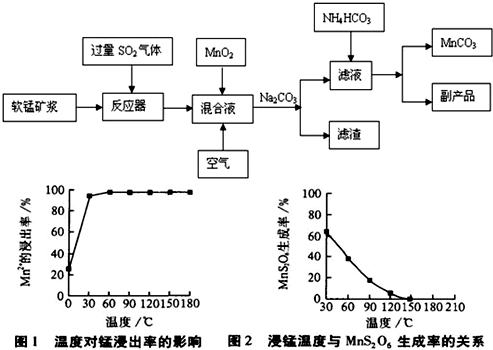
 MnS2O6的△H
MnS2O6的△H