题目内容
【题目】本题为《化学反应原理(选修4)》选做题。
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_____性,原因是___________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于___________;
(3)已知在H2S溶液中存在下列平衡:H2S![]() HS-+H+
HS-+H+
①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向______移动,(填“左”或“右”)c(H+)_________。(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向______移动,(填“左”或“右”)c(S2-)_________。(填“增大”、“减小”或“不变”)
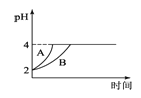
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);
(5)难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002molL-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10-11)
【答案】(1)碱 CO32-+H2O![]() HCO3-+OH-(2)4 (3) ①右 减小 ②左 增大
HCO3-+OH-(2)4 (3) ①右 减小 ②左 增大
(4) B < (5) 10
【解析】试题分析:(1)酚酞遇碱变红色,该溶液呈红色说明是碱性溶液,原因是CO32-水解,发生水解反应的离子反应式为CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的c(H+)=![]() =0.0001mol/L=1×10-4mol/L,故pH值等于4;
=0.0001mol/L=1×10-4mol/L,故pH值等于4;
(3)①向H2S溶液中加入NaOH固体时,OH-中和电离平衡中的H+,促进电离平衡向右移动,(填“左”或“右”)c(H+)减小;
②向H2S溶液中加入NaHS固体时,增大HS-浓度,电离平衡向左移动,但溶液中c(S2-)增大;
(4)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2;
(5)0.002molL-1MgSO4溶液中c(Mg2+)=0.0002mol/L,沉淀平衡时c(OH-)=![]() =
=![]() mol/L=10-4mol/L,则c(H+)=10-10mol/L,所以溶液的pH=-lgc(H+)=10,故应调整溶液pH大于10。
mol/L=10-4mol/L,则c(H+)=10-10mol/L,所以溶液的pH=-lgc(H+)=10,故应调整溶液pH大于10。




