题目内容
【题目】C、N、P、S、Fe、Cu是与人类生产、生活息息相关的化学元素,利用所学知识回答下列问题:
(1)基态Cu原子核外电子排布式为___,则高温下的稳定性CuO___Cu2O(填“>”或“<”);
(2)经研究Cu的某种化合物能催化氧化CO(NH2)2,其中C、N的杂化方式分别为___,___;
(3)Si、P、S元素的第一电离能由大到小的顺序是___;
(4)OF2的空间构型是___,分子极性:H2O___OF2(填“>”或“<”),理由是___;
(5)[Fe(CN)6]3-中配位键和π键的个数之比为___;
(6)邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,原因是___。
【答案】[Ar]3d104s1或1s22s22p63s23p63d104s1 < sp2 sp3 P>S>Si V形 > 二者结构相似,均为V形,F与O的电负性相对比较接近,所以O-F键的极性较弱,故OF2分子的极性也较弱 1:2 邻羟基苯甲醛形成了分子内氢键,而对羟基苯甲醛形成了分子间氢键,故前者沸点低
【解析】
同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,第IIA和第IIIA族、第VA和第VIA族反常;有机物沸点与碳原子个数和氢键有关。
(1)根据核外电子排布规律,铜原子序数为29,基态Cu原子核外电子排布式为[Ar]3d104s1或1s22s22p63s23p63d104s1;铜的价电子是3d104s1,在高温时,容易失去外层4s1上的一个电子,形成3d10的电子结构,根据洪特规则,轨道全满半满和空的时候能量低,所以高温时1价铜比2价铜稳定,则高温下的稳定性CuO<Cu2O;
(2)经研究Cu的某种化合物能催化氧化CO(NH2)2,化合物中C原子含有3个σ键且不含孤电子对,所以其杂化方式为sp2,N原子分别含有3个σ键且含有一个孤电子对,所以N原子采用sp3杂化;
(3)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,第IIA和第IIIA族、第VA和第VIA族反常,Si、P、S三种元素原子的第一电离能由大到小的顺序是P>S>Si;
(4)由价层电子对互斥理论可知,OF2中中心原子为O,F为配位原子, 价层电子对数=![]() ,成键电子对数为2,孤电子对数为4-2=2,电子对构型为正四面体 ,孤电子对越多,排斥力越大,所以OF2分子构型为V型,分子极性:H2O>OF2,理由是二者结构相似,均为V形,F与O的电负性相对比较接近,所以O-F键的极性较弱,故OF2分子的极性也较弱;
,成键电子对数为2,孤电子对数为4-2=2,电子对构型为正四面体 ,孤电子对越多,排斥力越大,所以OF2分子构型为V型,分子极性:H2O>OF2,理由是二者结构相似,均为V形,F与O的电负性相对比较接近,所以O-F键的极性较弱,故OF2分子的极性也较弱;
(5)[Fe(CN)6]3-结构中,一个CN-含有1个σ键,2个π键且每次CN-与铁以配位键相结合,配位键和π键的个数之比为1:2;
(6)邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,原因是邻羟基苯甲醛形成了分子内氢键,而对羟基苯甲醛形成了分子间氢键,故前者沸点低。

【题目】I.配制250mL0.5mol/L的NaOH溶液,所需的仪器有烧杯、玻璃棒、托盘天平、胶头滴管和_______。定容时俯视观察刻度线,其结果_______。(填“偏大”、“偏小”、或“不变”)
Ⅱ.实验室用加热固体氯化铵和氢氧化钙的混合物制取氨气,反应的化学方程式是_______;所制得的气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出合适选择,并将对应选择的装置编号字母填入表中的空格处:
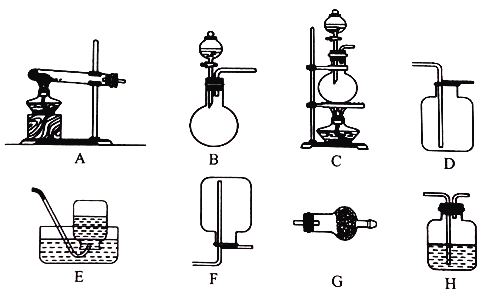
试剂:a. NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰
f.品红溶液 g.湿润的红色石蕊试纸
制取气体 | 杂质气体 | 制取气体的 发生装置 | 收集装置 | 净化装置中 所用的试剂 | 检验制得的气体 所用试剂 |
NH3 | H2O(g) | _______ | F | e | _______ |
【题目】利用![]() 可消除
可消除![]() 的污染,反应原理为:
的污染,反应原理为:![]() ,在10L密闭容器中分别加入
,在10L密闭容器中分别加入![]() 和
和![]() ,测得不同温度下
,测得不同温度下![]() 随时间变化的有关实验数据如表所示:
随时间变化的有关实验数据如表所示:
组别 | 温度 | 时间 物质的量 | 0 | 10 | 20 | 40 | 50 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| M |
|
下列说法正确的是
A.组别![]() 中
中![]() 内,
内,![]() 降解速率为
降解速率为![]()
B.由实验数据可知温度![]()
C.![]() 时,表格中M对应的数据为
时,表格中M对应的数据为![]()
D.该反应只有在高温下才能自发进行
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D