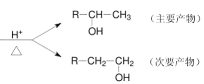
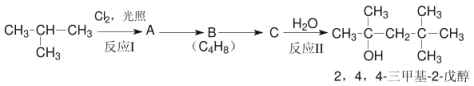
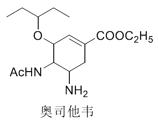
题目内容
【题目】常温下用![]() 盐酸分别滴定
盐酸分别滴定![]() 浓度均为
浓度均为![]() 的NaOH溶液和二甲胺
的NaOH溶液和二甲胺![]() 溶液
溶液![]() 在水中电离方式与氨相似
在水中电离方式与氨相似![]() ,利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。
,利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。
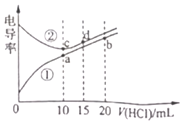
①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于1.0×10-7![]() 的是______,原因为______。
的是______,原因为______。
②化学反应往往伴有热效应,若为绝热体系,a的温度______![]() 填“
填“![]() ”,“
”,“![]() ”或“
”或“![]() ”
”![]() 点的温度。
点的温度。
【答案】a 此时恰好生成强酸弱碱盐,对水的电离有促进作用 ![]()
【解析】
①NaOH属于强碱,二甲胺的水溶液属于弱碱溶液,曲线①为滴定二甲胺溶液;强酸弱碱盐,对水的电离有促进作用;
②酸碱中和反应为放热反应,二甲胺的电离吸热,若为绝热体系a的温度<c点的温度。
①NaOH属于强碱,二甲胺的水溶液属于弱碱溶液,曲线①为滴定二甲胺溶液;碱或酸过量,会抑制水的电离,盐类水解促进水的电离,滴定终点前碱过量,滴定终点后酸过量,恰好完全滴定时形成盐,NaCl不会水解,而(CH3)2NH2+会水解,加入10mL盐酸时恰好完全反应,因此,a、b、c、d四点的溶液中,a点由水电离出氢离子浓度大于1.0×10-7molL-1;因为此时恰好生成强酸弱碱盐,对水的电离有促进作用,故答案为:a;此时恰好生成强酸弱碱盐,对水的电离有促进作用;
②酸碱中和反应为放热反应,二甲胺的电离过程吸热,若为绝热体系,则a的温度<c点的温度,故答案为:<。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目