题目内容
17.运用表中电离常数判断,可以发生的反应是( )| 酸 | 电离常数(25℃) |
| 碳酸 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| 次溴酸 | Ka=2.4×10-9 |
| A. | HBrO+Na2CO3═NaBrO+NaHCO3 | B. | 2HBrO+Na2CO3═2NaBrO+H2O+CO2↑ | ||
| C. | HBrO+NaHCO3═NaBrO+H2O+CO2↑ | D. | NaBrO+NaHCO3═Na2CO3+HBrO |
分析 相同温度下,酸的电离平衡常数越大,酸的酸性越强,一般来说,强酸能和弱酸的盐反应生成弱酸,根据表中数据知,酸的酸性强弱顺序是H2CO3>HBrO>HCO3-,以此解答该题.
解答 解:A.HBrO的酸性大于HCO3-,所以HBrO+Na2CO3=NaBrO+NaHCO3能发生,故A正确;
B.酸性H2CO3>HBrO,所以碳酸钠和次溴酸反应不能生成二氧化碳,故B错误;
C.酸性H2CO3>HBrO,所以次溴酸和碳酸氢钠不反应,故C错误;
D.酸性H2CO3>HBrO>HCO3-,所以碳酸氢钠不能和次溴酸钠反应生成碳酸氢钠和次溴酸,故D错误.
故选A.
点评 本题考查了弱电解质的电离,为高频考点,侧重考查学生的分析能力,明确酸的电离平衡常数与酸的酸性强弱关系是解本题关键,再结合强酸制取弱酸来分析解答,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.由A、B、C、D四种金属按表中装置进行试验,下列叙述中正确的是( )
| 实验装置与现象 | |||
| 装置 | 甲 | 乙 | 丙 |
 |  |  | |
| 现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
| A. | 装置甲中的A处发生了还原反应 | B. | 装置乙中的C金属是负极 | ||
| C. | 装置丙中的D金属是原电池的正极 | D. | 四种金属的活泼性顺序是D>A>B>C |
8.下列反应中,属于加成反应的是( )
| A. | CH2═CH2+Br2→CH2Br-CH2Br | B. | B、CH3CH2OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O | ||
| C. |  | D. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl |
5.由于易被氧化而不宜长期存放的溶液是( )
| A. | 氢硫酸 | B. | 硫酸钠溶液 | C. | 漂白粉 | D. | 浓硫酸 |
12.下列叙述中,正确的是( )
| A. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| B. | 聚乙烯可发生加成反应 | |
| C. | 油脂为高分子化合物 | |
| D. | 符合分子式C5H12的物质有4种 |
2.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 常温常压下,71g氯气与足量金属钠充分反应,转移的电子数为2 NA | |
| B. | 1.8g的NH4+离子中含有的电子数NA | |
| C. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA | |
| D. | 1 mol/L MgSO4溶液中所含SO42-数目为NA |
6.NaF、NaI、MgO均为离子化合物,现有下列数据,试判断三种化合物的熔点、沸点高低的顺序是
( )
( )
| 物质 | ①NaF | ②NaI | ③MgO |
| 离子电荷数 | 1 | 1 | 2 |
| 离子的核间距 | 23.1nm | 31.8nm | 21.0nm |
| A. | ①>②>③ | B. | ③>②>① | C. | ③>①>② | D. | ②>①>③ |
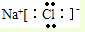 .
. 已知:2NaOH+Cl2=NaClO+NaCl+H2O.标准状况下,H2和 Cl2的混合气体共2.24L,光照充分反应后,用NaOH充分吸收.
已知:2NaOH+Cl2=NaClO+NaCl+H2O.标准状况下,H2和 Cl2的混合气体共2.24L,光照充分反应后,用NaOH充分吸收.