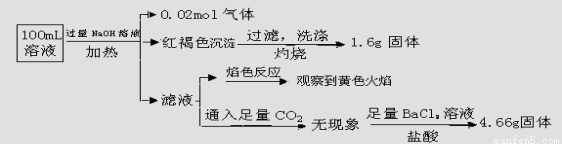
题目内容
甲、乙两组同学利用如下两反应(K为25℃时的平衡常数)设计成原电池(装置如图)。
① AsO43—+2I-+2H+ AsO33-+I2+H2O K1=14.2
AsO33-+I2+H2O K1=14.2
② 2Fe3++2I- 2Fe2++I2 K2=1.1×108
2Fe2++I2 K2=1.1×108
左池溶液都相同(KI-I2溶液),右池溶液不同:甲组为Na3AsO4和Na3AsO3的混合溶液,乙组为FeCl3和FeCl2的混合溶液。

当电流表指针指向零点后再改变右池的条件,改变的条件及电流表指针偏转情况记录如下:
操作 | 电流表指针偏转情况 | |
甲组 | 若滴加浓盐酸 | 偏向左方 |
若滴加浓NaOH溶液 | 偏向右方 | |
乙组 | 若滴加浓FeCl2溶液 | 不偏转 |
若滴加浓FeCl3溶液 | 偏向左方 |
则下列叙述错误的是( )
A.同温同浓度时,氧化性:Fe3+>AsO43—
B.与反应②比较,反应①平衡常数小,可逆程度大
C.左池中滴加淀粉溶液变蓝色,再加入足量FeCl2固体,蓝色会褪去
D.甲组在右池加入浓NaOH溶液,此时石墨Ⅱ为负极,AsO33—被氧化
练习册系列答案
相关题目
根据下列 实验操作和现象所得出的结论错误的是
实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向FeBr2溶液中通入少量Cl2 | 溶液由浅绿 色变为黄色 | 氧化性:Cl2>Fe3+ |
B | 向Na2SO3溶液中滴加盐酸 | 有气体产生 | 非金属性:Cl>S |
C | 向PH=3的HA和HB溶液中分别加水稀释至100倍 | pH(HA)>pH(HB) | 酸性:HA>HB |
D | 向重晶石中加入饱和碳酸钠溶液 | 重晶石逐渐溶解 | 溶度积:Ksp(BaCO3)<Ksp(BaSO4) |


 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( ) s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
s)═3AlCl(g)+3CO(g) △H=akJ·mol-1 N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下: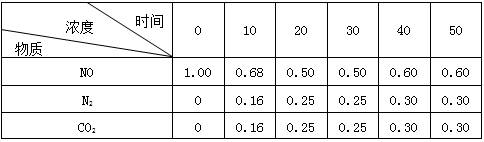
 发生改变
发生改变