题目内容
铜是一种重要的金属元素,位于元素周期表第ⅠB族,+1价的铜与氯离子结合的生成的CuCl是一种难溶物质,但它可与过量的Cl-形成可溶于水的络离子[CuCl2] -。含铜最丰富的天然资源是黄铜矿(CuFeS2)。
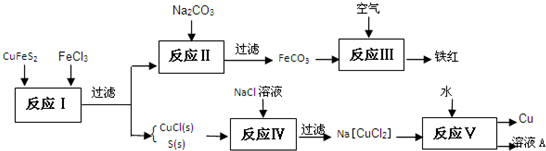
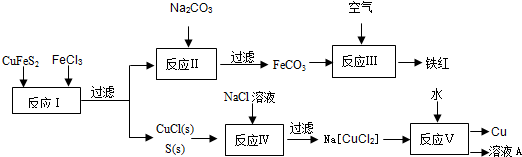
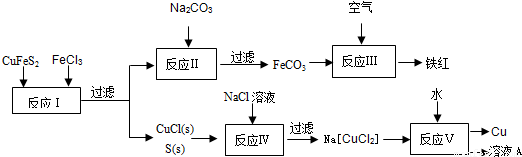
(1)目前有一种湿法冶炼技术,以黄铜矿为主要原料来生产铜、铁红颜料和可用于橡胶硫化的硫单质,原料的综合利用率较高。其主要流程如下:

①请完成反应Ⅰ中FeCl3与CuFeS2反应的化学方程式:
CuFeS2 + FeCl3 = +4 + 2S。
②写出反应Ⅳ中发生反应的离子方程式:
。
③反应Ⅲ是FeCO3在空气中煅烧,其化学方程式是
。
④已知Cu+ 在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu。则反应Ⅴ所得溶液A中含有的溶质有 。
(2)传统工艺从黄铜矿冶炼粗铜的技术,是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。与上面湿法冶炼技术方法比较,新方法的优点是 、 。
((16分)
(1)(共12分)
① 3 CuCl FeCl2(3分)
② Cl-+ CuCl = [CuCl2]-(2分)
③ 4FeCO3
+ O2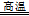 4CO2
+ 2Fe2O3 (3分)
4CO2
+ 2Fe2O3 (3分)
④ CuCl2、 NaCl (4分)
(2)(共4分)不会产生SO2污染大气(2分),不用煅烧黄铜矿从而节约热能 [或可得副产品铁红和硫,合理答案都行。2分]
【解析】
试题分析:(1)①读图可知,缺少的生成物为FeCl2、CuCl,硫元素由—2升为0,设CuFeS2的系数为1,则2个硫原子升高总数为4,铜元素由+2降为+1,1个铜原子降低数为1,由于升降总数相等,则铁元素由+3降为+2,需要3个铁原子降低总数3,则CuFeS2+3FeCl3=CuCl+4FeCl2+2S;②依题意,难溶的CuCl与可溶的NaCl在水中发生反应,其原理为Cl-+ CuCl =
[CuCl2]-;③依题意,该反应的反应物是FeCO3和O2,生成物是Fe2O3和CO2,铁元素由+2升为+3价,氧元素由0降为—2价,根据最小公倍数法配平可得:4FeCO3
+ O2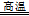 4CO2
+ 2Fe2O3;依题意,Na[CuCl2]在水中发生反应V,铜元素由+1部分升高为+2,部分降低为0,则溶液A中含有Cl-、Cu2+和Na+,所以推断A的溶质主要是CuCl2和NaCl;(2)传统方法需要高温煅烧,不仅消耗大量的能量,而且还产生大量的SO2等有毒气体,污染空气,新方法的优点是不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能,可得副产品铁红和硫。
4CO2
+ 2Fe2O3;依题意,Na[CuCl2]在水中发生反应V,铜元素由+1部分升高为+2,部分降低为0,则溶液A中含有Cl-、Cu2+和Na+,所以推断A的溶质主要是CuCl2和NaCl;(2)传统方法需要高温煅烧,不仅消耗大量的能量,而且还产生大量的SO2等有毒气体,污染空气,新方法的优点是不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能,可得副产品铁红和硫。
考点:考查有关物质制备的化学工艺流程推断题,涉及化学方程式的配平、主要流程中离子方程式、推断溶液的主要溶质、评价两种工艺的优缺点等。