题目内容
长期存放的亚硫酸钠可能会被部分氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:
①称量a g样品,置于烧杯中。
②加入适量蒸馏水,使样品溶解。
③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液。
④过滤,用蒸馏水洗涤沉淀。
⑤加热干燥沉淀物。
⑥将沉淀物冷却至室温后,称量。
⑦重复⑤⑥操作直到合格,最后得到b g固体。
完成下面问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?(填“能”或“不能”)其理由是:
________________________________________________________________________。
(2)步骤③中加盐酸,使溶液呈强酸性的目的是:
____________________________________________________________________________。
(3)步骤⑦的“合格”标准是:__________________________________________________。
(4)实验测得的样品中无水亚硫酸钠的质量分数是:__________(列出算式,不需要化简)。
:(1)不能 在酸性溶液中,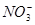 将
将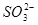 氧化成
氧化成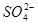 ,而干扰实验的测定
,而干扰实验的测定
(2)保证得到的沉淀全部是硫酸钡而无亚硫酸钡 (3)连续两次称量的质量不变
(4)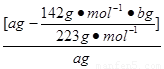 ×100%
×100%
【解析】
试题分析:在Na2SO3(Na2SO4)中先加盐酸后,再加BaCl2,不能用Ba(NO3)2代替BaCl2,因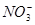 在H+存在下有强氧化性,将
在H+存在下有强氧化性,将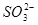 氧化成
氧化成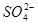 影响实验测定。③中加盐酸呈强酸性的目的是2H++
影响实验测定。③中加盐酸呈强酸性的目的是2H++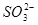 ====H2O+SO2↑,再加BaCl2时,保证沉淀中只有BaSO4而无BaSO3。步骤⑦中操作合格标准,连续两次称量的质量不变。
====H2O+SO2↑,再加BaCl2时,保证沉淀中只有BaSO4而无BaSO3。步骤⑦中操作合格标准,连续两次称量的质量不变。
(4)中BaSO4 — Na2SO4
233 g 142 g
b g m(Na2SO4)
m(Na2SO4)=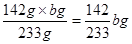
考点:考查亚硫酸钠纯度测定的有关实验设计的判断
点评:该题是中等难度的试题,也是高考中的常见实验题。试题基础性强,侧重对性质实验能力的培养和训练,有利于培养学生的逻辑推理能力和规范实验设计以及动手操作能力。综合性强,理论和实践的联系紧密,要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。有利于培养学生的应试能力,提高学生的学习效率。

 阅读快车系列答案
阅读快车系列答案 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案: