题目内容
在500℃时,发生可逆反应2SO2(g)+O2(g) 2SO3(g);ΔH<0。向甲容器中充入1molSO2和0.5molO2,向相同容积的乙容器中充入1molSO3。若甲容器保持容积不变,乙容器保持压强不变,分别达平衡,下列说法不正确的是:
2SO3(g);ΔH<0。向甲容器中充入1molSO2和0.5molO2,向相同容积的乙容器中充入1molSO3。若甲容器保持容积不变,乙容器保持压强不变,分别达平衡,下列说法不正确的是:
 2SO3(g);ΔH<0。向甲容器中充入1molSO2和0.5molO2,向相同容积的乙容器中充入1molSO3。若甲容器保持容积不变,乙容器保持压强不变,分别达平衡,下列说法不正确的是:
2SO3(g);ΔH<0。向甲容器中充入1molSO2和0.5molO2,向相同容积的乙容器中充入1molSO3。若甲容器保持容积不变,乙容器保持压强不变,分别达平衡,下列说法不正确的是:| A.平衡时,容器内的压强:甲>乙 | B.反应达平衡时所需时间:甲<乙 |
| C.平衡时,氧气的浓度:甲<乙 | D.平衡时,容器内SO3的体积百分数:甲>乙 |
C
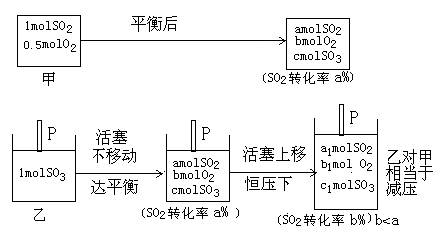
起始时,甲、乙两容器体积相同,在同温下,若保持乙容器体积不变,则两容器达到同一平衡状态,即等效平衡。而实际上乙是恒压容器,加入1mol SO3反应向逆向进行,混合气体的总物质的量增大,活塞P上移,容器的体积扩大。这一过程乙对甲相当于减压,平衡逆移。因此,达平衡时,容器内压强:甲>乙;A正确。达平衡的时间乙容器长∴甲<乙B正确。平衡时氧气的浓度:甲>乙,虽然平衡逆移,O2的物质的量增多,但容器体积的增大为主要因素,即只能“减弱”这种改变,不能“消除”(平衡移动原理)。C错;平衡时,容器内SO3的体积百分数:甲>乙(因SO2的转化率减小);D正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 H2(g)+I2(g);△H>0。下列说法正确是
H2(g)+I2(g);△H>0。下列说法正确是 2Z(g)不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如下图所示,下列判断正确的是( )
2Z(g)不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如下图所示,下列判断正确的是( ) 
 cC(气)有如下性质:
cC(气)有如下性质: 2C(g),2 min后,参加反应的各物质的浓度分别为c(A)="0.5" mol ·L-1,c(B)="0.75" mol ·L-1,c(C)="0.5" mol ·L-1,试计算A和B起始的物质的量。
2C(g),2 min后,参加反应的各物质的浓度分别为c(A)="0.5" mol ·L-1,c(B)="0.75" mol ·L-1,c(C)="0.5" mol ·L-1,试计算A和B起始的物质的量。  CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是 CO2(g)+H2(g),且平衡常数K=1,若用2mol CO和10mol H2O(g)相互混合并加热到800℃,则CO的转化率为多少?
CO2(g)+H2(g),且平衡常数K=1,若用2mol CO和10mol H2O(g)相互混合并加热到800℃,则CO的转化率为多少?