题目内容
【题目】在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为
ρ g·cm-3,质量分数为w,其中含NH![]() 的物质的量为b mol。下列叙述中正确的是( )
的物质的量为b mol。下列叙述中正确的是( )
A. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
B. 溶质的质量分数为w=![]() ×100%
×100%
C. 溶液中c(OH-)=![]() mol·L-1
mol·L-1
D. 上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w
【答案】A
【解析】A. a g NH3的物质的量为![]() mol,则溶质的物质的量浓度c=
mol,则溶质的物质的量浓度c=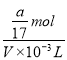 =
=![]() mol·L-1,故A正确;B. 溶质的质量分数为w=
mol·L-1,故A正确;B. 溶质的质量分数为w=![]() ×100%,故B错误;C. 溶液中的OH来源于一水合氨的电离和水的电离,NH4+的浓度为:bmol÷V×103L=
×100%,故B错误;C. 溶液中的OH来源于一水合氨的电离和水的电离,NH4+的浓度为:bmol÷V×103L=![]() mol/L,一水合氨的电离方程式为:NH3H2ONH4++OH,由电离方程式可知,一水合氨电离出的OH浓度为
mol/L,一水合氨的电离方程式为:NH3H2ONH4++OH,由电离方程式可知,一水合氨电离出的OH浓度为![]() mol/L,由溶液电荷守恒得:c(OH)= c(NH4+)+c(H+)=
mol/L,由溶液电荷守恒得:c(OH)= c(NH4+)+c(H+)=![]() molL1+c(H+),故C错误;D. 水的密度大于氨水,相等体积的氨水和水相比,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,混合液中氨气的质量与原氨水中氨气的质量相同,等体积混合所得溶液溶质的质量分数小于0.5w,故D错误;答案选A。
molL1+c(H+),故C错误;D. 水的密度大于氨水,相等体积的氨水和水相比,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,混合液中氨气的质量与原氨水中氨气的质量相同,等体积混合所得溶液溶质的质量分数小于0.5w,故D错误;答案选A。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案【题目】在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:A(g) B(g)+C(g)
ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________________________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为________,平衡时A的转化率为________,列式并计算反应的平衡常数K_______________________________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是______________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为________mol·L-1。